
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| m |
| n |
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1所示装置可制取乙炔 |
| B、图2所示装置可分离乙酸乙酯和醋酸钠的水溶液 |
| C、图3所示装置可制取乙烯并验证其易被氧化 |
| D、图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3、CO、CO2都是极性分子 |
| B、CH4、CO2都是含有极性键的非极性分子 |
| C、HF、HCl、HBr的沸点依次增强 |
| D、CS2、H2O、C2H2都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
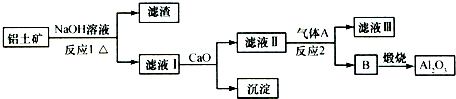
| A、气体A一定为HCl |
| B、滤液Ⅰ中溶质仅含NaAlO2 |
| C、沉淀的主要成分为硅酸钙 |
| D、反应1、反应2均不是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com