
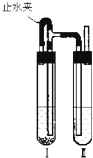
 用下面两种方法可以制得白色的Fe(OH)2沉淀:
用下面两种方法可以制得白色的Fe(OH)2沉淀:

 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
| A、6g C(石墨)不完全燃烧得到CO2和CO的混合物,C转移的电子数小于2NA | B、0.1mol正丁烷和异丁烷的混合物中含有的碳氢键的数目为NA | C、常温常压下,2.24L 18O2中含有的中子数为2NA | D、100℃时,1L pH=1的硫酸溶液中,含有0.1NA个H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Al3+含有的核外电子数为3NA | B、将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol?L-1 | C、1mol Cl2与足量的铁反应,转移的电子数为3NA | D、常温下,10L pH=1的硫酸溶液中含有的H+离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5% | B、25% | C、50% | D、75% |
查看答案和解析>>
科目:高中化学 来源: 题型:
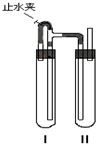 由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法.甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备.
由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法.甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | (35±15)mg?kg-1(以I计) |
| 使用方法 | 勿长时间炖炒,食品熟后加入 |
| A、此食盐是纯净物 |
| B、“勿长时间炖炒”的原因可能是碘酸钾受热不稳定 |
| C、仅用淀粉溶液就可以检验此食盐中是否含碘 |
| D、1kg此食盐中含碘酸钾(35±15)mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性 | B、向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4 难溶于盐酸 | C、在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,无红色沉淀,说明淀粉未水解 | D、向2.0mL浓度均为0.1mol?L-1 的KCl、KI混合溶液中滴加1~2滴0.01mol?L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气排放 | B、建筑扬尘 | C、煤燃烧 | D、风力发电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com