
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
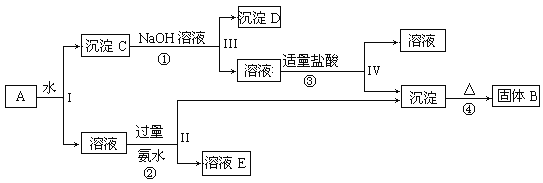
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___________。
(2)写出①、②、③离子方程式④化学反应方程式
①____________________________;②___________________________;
③____________________________;④____________________________。
【答案】过滤 Al2O3+2OH-=2AlO2-+H2O Al3++3NH3·H2O=Al(OH) 3↓+3NH4+ AlO2-+H++H2O=Al(OH) 3↓ 2Al(OH) 3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
由实验流程可知,混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤分离可得溶液KAl(SO4)2和Al2O3、Fe2O3沉淀混合物C,加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3,加入盐酸得到FeCl3,NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液E为K2SO4和(NH4)2SO4混合物,以此来解答。
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是过滤,故答案为:过滤;
(2)Al2O3和Fe2O3不溶于水,过滤后得到沉淀C(Al2O3和Fe2O3)与滤液(KAl(SO4)2),则过程①为沉淀C中的Al2O3可溶于强碱,其离子方程式为:Al2O3+2OH-=2AlO2-+H2O;过程②为KAl(SO4)2与过量氨水的反应,其离子方程式为: Al3++3NH3·H2O=Al(OH) 3↓+3NH4+;操作III过滤得到滤液的主要成分为NaAlO2,加入适量盐酸:AlO2-+H++H2O=Al(OH) 3↓;经操作IV得到的沉淀为Al(OH) 3,其加热脱水可得到Al2O3,发生的化学方程式为:2Al(OH) 3![]() Al2O3+3H2O,
Al2O3+3H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3·H2O=Al(OH) 3↓+3NH4+;AlO2-+H++H2O=Al(OH) 3↓;2Al(OH) 3![]() Al2O3+3H2O。
Al2O3+3H2O。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向恒容密闭容器中投入一定量的X,反应3X(g)2Y(g)+Z(g)+W(s),△H=-QkJmol-1,反应已达到平衡的标志是( )
A. 混合气体的密度不再改变B. 混合气体的压强不再变化
C. 反应混合物中![]() 不再改变D.
不再改变D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______
(2)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为______
②该温度下的反应的平衡常数为______
(3)一定条件下的密闭容器中,在总反应达到平衡前,要使在单位时间内提高CO的转化率,可以采取的措施是______
A 增大压强 B 加入催化剂C 减少CO2的浓度 D 降低体系温度
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图1,试解释原因:______
(5)该研究者还测定了相同条件下氢气的残留量,请在图2中划出H2的残留量随温度变化的曲线______
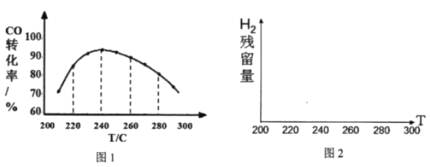
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲表示叶绿体的结构,图乙表示暗反应过程。请据图回答下列问题:

(l)叶绿体中的色素分布于图甲中的____ (填序号);四种色素能在滤纸条上分离,是因为____。
(2)叶绿体进行光合作用时,ATP的移动方向是从____到____(填序号),合成ATP所需的能量来自____。
(3)在光照强度、温度和CO2浓度三种环境因素中,能直接影响图乙所示过程的是 _________。若突然降低光照强度,则在短时间内叶绿体中C3和C5的含量变化分别是 _________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物的用途广泛,例如:“84”消毒液的有效成分是次氯酸钠,漂白精的有效成分是次氯酸钙,洁厕剂的有效成分是盐酸。已知酸性: H2CO3>HClO>HCO3-。下列有关说法正确的( )
A. “84”消毒液与洁厕剂混合使用,能增强漂白或去污效果
B. 工业上制取漂白粉往往是向澄清石灰水中通入足量氯气
C. 可设计实验装置,用电解饱和食盐水的方法制备次氯酸钠溶液
D. 向“84”消毒液中通入少量CO2,反应的化学方程式为2NaClO+CO2+H2O==Na2CO3+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。
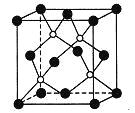
下列有关说法正确的是( )
A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________。PAN中四种元素的第一电离能由大到小的顺序为________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________,中心离子的核外电子排布式为________________________。
③ 相同压强下,乙醇的沸点比CH3OCH3________(填“高”或“低”),其原因是_____________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________(填数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室废液中含有Fe3+、Fe2+、Cu2+、Ag+四种金属阳离子,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
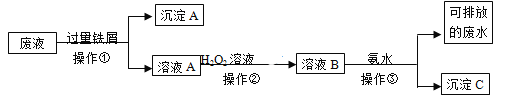
⑴沉淀A的成分是__________________________
⑵操作②中观察到的实验现象是__________________________________________________。
⑶设计一个实验方案,检验可排放的废水中不含Fe3+____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商代炼铜时,所用的矿物原料主要是孔雀石,主要燃料是木炭,在温度1000℃左右冶炼,可能涉及的反应有:
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O;
2CuO+CO2↑+H2O;
②2CuO+C![]() 2Cu+CO2↑;
2Cu+CO2↑;
③CuO+CO![]() Cu+CO2;
Cu+CO2;
④CO2+C![]() 2CO。
2CO。
(1)从四种基本反应类型来看,①②④的反应类型分别为①___________,②___________,④___________。
(2)反应③中,____________发生氧化反应,__________发生还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com