
【题目】电解装置如图所示:

Ⅰ.当用惰性电极电解时,c为____________极, d极的电极反应_________,电解总反应的化学方程____________________
Ⅱ.(1)若用此装置进行铁上镀铜则c为__________(填铁或铜),电解液浓度_____________(增大,减小或不变)
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________mol.
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________(填图中的字母)。
【答案】阳极 2Cu2++4e-=2Cu 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 铜 不变 0.25mol c
2Cu+O2↑+2H2SO4 铜 不变 0.25mol c
【解析】
I.根据电解装置图可知,当用惰性电极电解时,c与电源的正极相连,则c为阳极,d为阴极;
Ⅱ.(1)要实现在铁制品上镀铜,铁制品需作阴极,镀层铜作阳极,含镀层金属阳离子的盐溶液作电解质溶液;
(2)根据阳极:Cu-2e-→Cu2+、阴极:Cu2++2e-→Cu及电极质量差进行计算;
Ⅲ. 电解精炼时,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液。
I.根据电解装置图可知,当用惰性电极电解时,c与电源的正极相连,则c为阳极;d与电源的负极相连,则d为阴极,溶液中的铜离子在阴极放电生成铜,电极反应为2Cu2++4e-=2Cu;阴极、阳极电极反应相加得到电池的总反应,则电解总反应的化学方程为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
Ⅱ.(1)要实现在铁制品上镀铜,铁制品需作阴极,镀层铜作阳极,含镀层金属阳离子的盐溶液作电解质溶液,所以c为铜,d为铁,阳极铜放电,阴极溶液中的铜离子放电,则电解液浓度不变;
(2)根据阳极:Cu-2e-→Cu2+、阴极:Cu2++2e-→Cu 两极质量差为128,当两极质量差为16g,说明转移的电子为![]() ×2mol=0.25mol;
×2mol=0.25mol;
Ⅲ. 电解精炼时,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来,所以粗铜板是图中电极c。


科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化如图所示(忽略过程中的体积变化)。下列说法不正确的是
A. 25℃时,H2A的第二步电离平衡常数约为10-6
B. 水的电离程度:N>M>P
C. 随着盐酸的不断滴入,最终溶液的pH小于2
D. P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。回答下列问题:
(1)基态锗原子最外层电子排布图为_______,Ge原子的电子发生跃迁时会吸收或放出不同的光,可用_______![]() 填仪器名称
填仪器名称![]() 摄取其原子光谱,从而鉴定Ge元素的存在。
摄取其原子光谱,从而鉴定Ge元素的存在。
(2)锗元素能形成无机化合物![]() 如锗酸钠:
如锗酸钠:![]() ;二锗酸钠:
;二锗酸钠:![]() ;四锗酸钠:
;四锗酸钠:![]() 等
等![]() ,也能形成类似于烷烃的锗烷
,也能形成类似于烷烃的锗烷![]() 。
。
![]() 中锗原子的杂化方式为______________。
中锗原子的杂化方式为______________。
![]() 锗与碳同族,性质及结构有一定的相似性,据此推测
锗与碳同族,性质及结构有一定的相似性,据此推测![]() 二锗酸钠
二锗酸钠![]() 中含有的
中含有的![]() 键的数目为_________。
键的数目为_________。
![]() 至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________。
至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因:___________________。
化学键 |
|
|
|
|
键能 | 346 | 411 | 188 | 288 |
(3)有机多元膦酸锗配合物是由![]() Ⅳ
Ⅳ![]() 与
与![]() 形成的,其结构如下:
形成的,其结构如下:
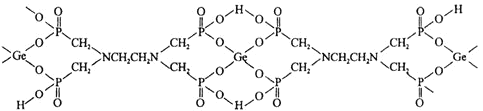
![]() 该配合物中,下列作用力不存在的有_________
该配合物中,下列作用力不存在的有_________
A.极性键 ![]() 非极性键
非极性键 ![]() 金属键
金属键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 键
键
![]() 该配合物中
该配合物中![]() Ⅳ
Ⅳ![]() 的配位数是_______;配位原子是_______
的配位数是_______;配位原子是_______![]() 填元素符号
填元素符号![]() 。
。
![]() 试解释磷酸
试解释磷酸![]() 酸性为什么与亚硝酸相近?______________。
酸性为什么与亚硝酸相近?______________。
(4)![]() 常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数
常作为军事上的红外制导材料,其理想晶胞如图所示。测得晶胞参数![]() ,
,![]() ,该晶体的密度为_______
,该晶体的密度为_______![]() 列出算式即可,阿伏加德罗常数用
列出算式即可,阿伏加德罗常数用![]() 表示
表示![]() 。
。

![]() 原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则
原子的分数坐标即将晶胞参数a、b、c均看作“1”所得出的三维空间坐标,以1号Zn为坐标原点,则![]() 晶胞图中标号为“2”的P原子的分数坐标为_______。
晶胞图中标号为“2”的P原子的分数坐标为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
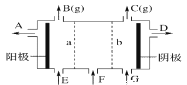
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-= 2H2O+O2↑
D.Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH―= FeO42―+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42―,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。回答下列问题:

(1)铁作________极,电极反应式为___________________________________________________。
(2)每制得1mol Na2FeO4,理论上可以产生标准状况 ____________ L 气体。
(3)电解一段时间后,c(OH―)降低的区域在_______________________(填“阴极室”或“阳极室”)。
(4)电解过程中,须将阴极产生的气体及时排出,其原因为_____________________。
(5)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析M点c(Na2FeO4)低于最高值的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
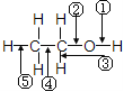
A. 和金属钠作用时,键①断裂
B. 和浓H2SO4共热至170℃时,键②和⑤断裂
C. 和浓H2SO4共热至140℃时,键③⑤断裂
D. 在Ag催化剂下和O2反应时,键①和③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将 ![]() 氨水滴入
氨水滴入 ![]() 盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.![]()
B.水的电离程度:![]()
C.c点:![]()
D.d点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是![]()
A.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
B.![]() 能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂
能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂
C.石油裂解和油脂皂化都有高分子生成小分子的过程
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和![]() 溶液除去
溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法不正确的是( )
A.![]() 的名称为2-甲基-1,3-二丁烯
的名称为2-甲基-1,3-二丁烯
B.含8个碳原子的有机物,每个分子中可能形成8个C—C单键
C.![]() 属于芳香烃且属于苯的同系物
属于芳香烃且属于苯的同系物
D.沸点比较:乙二醇>乙醇>乙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com