


科目:高中化学 来源: 题型:
| A、冶炼过程中的尾气可用来制硫酸 |
| B、上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 |
| C、在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 |
| D、电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氯化铁溶液中加入铁:Fe3++Fe=2Fe2+ |
| B、向AlCl3溶液中加入足量的氨水:Al3++4OH-=AlO2-+2H2O |
| C、铜与稀硝酸的反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D、氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
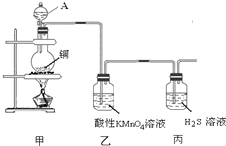 某化学课外小组利用如图装置探究SO2的性质.请回答下列问题:
某化学课外小组利用如图装置探究SO2的性质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2﹑CaO﹑K2O都是碱性氧化物 |
| B、BaSO4﹑NaCl﹑KNO3溶液都是电解质 |
| C、纯碱﹑烧碱﹑碱石灰都是碱 |
| D、稀豆浆﹑果冻﹑淀粉溶液都是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
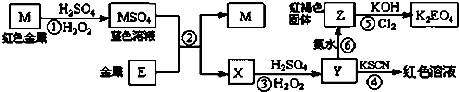
| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B、反应⑤的离子方程式可表示为:2E(OH)3+3Cl2+6H2O═3EO42-+6Cl-+12H+ |
| C、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| D、反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
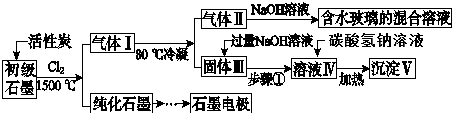
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com