
| A. | 用陈化的粮食酿造的酒精可以饮用 | |
| B. | 地沟油不能食用是因为反复加热会产生稠环芳香烃等有害物质 | |
| C. | 铜盐有毒,是因为可使蛋白质变性,但可以用于消毒、杀菌 | |
| D. | 用次氯酸盐,漂白、杀菌、消毒 |
分析 A.用陈化的粮食酿造的酒精含有黄曲霉素;
B.地沟油经反复加热可生成稠环芳香烃;
C.铜盐为重金属盐,可使蛋白质变性,可用于杀菌消毒;
D.次氯酸盐具有强氧化性,可生成具有漂白性的次氯酸.
解答 解:A.用陈化的粮食酿造的酒精含有黄曲霉素,可致癌,对人体有害,故A错误;
B.地沟油经反复加热可生成稠环芳香烃,可致癌,不能用于食用油,故B正确;
C.铜盐为重金属盐,可使蛋白质变性,可用于杀菌消毒,可用于除去害虫,故C正确;
D.次氯酸盐具有强氧化性,可用于杀菌消毒,可生成次氯酸,具有漂白性,故D正确.
故选A.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,为高频考点,有利于培养学生良好的科学素养,明确物质组成、性质、用途关系是解本题关键,会根据物质性质解释其用途,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
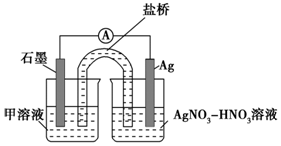
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a、b和c均能使酸性KMnO4溶液褪色 | |
| D. | b和c均能与新制的Cu(OH)2反应生成红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
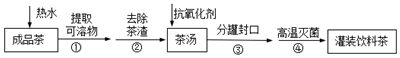
| A. | 步骤②是过滤 | |
| B. | 步骤③是分液,主要仪器是分液漏斗 | |
| C. | 步骤④高温灭菌的原理是使蛋白质细菌变性 | |
| D. | 茶多酚容易被氧化,抗氧化剂可选用维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性由强到弱的顺序:E、D、A | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:B、D、E | |
| C. | B、C、E形成的共价化合物CEB可以用来杀菌消毒 | |
| D. | 简单离子半径由大到小的顺序:D、E、B、C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶的透气小袋可防止食品因氧化而变质 | |
| B. | 燃烧煤、天然气、石油等排放的大量CO2是导致雾霾产生的原因 | |
| C. | 漂白精可用作消毒剂是由于Ca(ClO)2可转化为HClO | |
| D. | 小苏打能做糕点的膨松剂是由于NaHCO3能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 1mol简单氢化物分别溶于等体积的水中形成体系的pH:Z>Y>X | |
| C. | W与X或Y都能形成既含极性键,又含非极性键的化合物 | |
| D. | 在化合物A的分解反应中丙为氧化产物,丁为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com