
分析 (1)锂条在只含有CO2和O2混合气体的容器中燃烧,固体的质量包括为未反应锂的质量、生成的碳的质量和生成的氧化锂的质量,采用极限思维法,若锂全部与氧气反应生成固体量最大,假设锂没有反应,则固体量最少,计算出固体的范围,然后解答;
(2)放电时,该电池是原电池,正极上得电子发生还原反应;
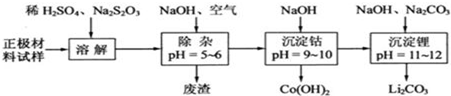
(3)正极材料(主要含有LiCoO2及少量Al、Fe等)溶于稀硫酸,Fe、Al和稀硫酸反应生成硫酸盐和氢气,发生的离子反应方程式为Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,酸性条件下S2O32-被氧化成SO42-,所以硫代硫酸钠和LiCoO2反应方程式为8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O;然后向溶液中充入空气,亚铁离子不稳定,易被氧化为铁离子,同时向溶液中加入NaOH溶液,发生的反应为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,所以调节溶液的pH为5-6时,铁离子、铝离子完全沉淀,过滤得到的废渣为 Al(OH)3、Fe(OH)3;
过滤后向溶液中再加入NaOH溶液并调节溶液的pH为9-10,发生的离子反应为Co2++2OH-=Co(OH)2↓,过滤得到Co(OH)2,最后向滤液中加入NaOH、Na2CO3并调节溶液的pH为11-12,发生的离子反应为2Li++CO32-=Li2CO3↓,
①酸性条件下,S2O32ˉ被氧化成SO42ˉ,则LiCoO2被氧化生成Co2+,根据离子方程式的书写规则,再根据氧化还原反应中得失电子结合原子守恒配平方程式;
②所以调节溶液的pH为5-6时,铁离子、铝离子完全沉淀,过滤得到的废渣为 Al(OH)3、Fe(OH)3.
解答 解:(1)锂条在只含有CO2和O2混合气体的容器中燃烧,固体的质量包括为未反应锂的质量、生成的碳的质量和生成的氧化锂的质量,
采用极限思维法,
如果生成固体质量最大,则假设无二氧化碳,锂完全与氧气反应,
4Li+O2 $\frac{\underline{\;点燃\;}}{\;}$2Li2O,
4 2
0.10mol 0.050mol
则0.1mol锂最多可生成固体的质量为0.050mol×30g/mol=1.5g,
再假设只有锂,则固体最少,固体质量为0.10mol×7g/mol=0.7克,
则固体的范围应该在0.7g<m<1.5g之间,
故答案为:0.7g<m<1.5g;
(2)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,
故答案为:CoO2+Li++e-=LiCoO2;
(3)正极材料(主要含有LiCoO2及少量Al、Fe等)溶于稀硫酸,Fe、Al和稀硫酸反应生成硫酸盐和氢气,发生的离子反应方程式为Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,酸性条件下S2O32-被氧化成SO42-,所以硫代硫酸钠和LiCoO2反应方程式为8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O;然后向溶液中充入空气,亚铁离子不稳定,易被氧化为铁离子,同时向溶液中加入NaOH溶液,发生的反应为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,所以调节溶液的pH为5-6时,铁离子、铝离子完全沉淀,过滤得到的废渣为 Fe(OH)3、Al(OH)3;过滤后向溶液中再加入NaOH溶液并调节溶液的pH为9-10,发生的离子反应为Co2++2OH-=Co(OH)2↓,过滤得到Co(OH)2,最后向滤液中加入NaOH、Na2CO3并调节溶液的pH为11-12,发生的离子反应为2Li++CO32-=Li2CO3↓,再结合题目分析解答,
①根据题意知,酸性条件下,S2O32ˉ被氧化成SO42ˉ,则LiCoO2被氧化生成Co2+,所以发生的离子反应方程式为:Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4,
故答案为:Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4;
②充入空气的目的是将亚铁离子氧化为铁离子,调节溶液的PH=5-6除去铁离子和铝离子,
故答案为:使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
点评 本题考查了化学方程式计算,原电池原理和离子除杂实验过程的理解应用,要求能定量地分析发生的反应,溶液中存在的离子,推断沉淀是否产生,从而得出正确的结论.计算强调了实用性以及认识、解决问题的综合性,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3+3CH4↑ | |
| C. | 根据化合价Fe3O4可表示为FeO•Fe2O3,则Pb3O4也表示为PbO•Pb2O3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.05NA | |
| B. | 常温下,1 L0.1mol/L的Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| C. | 标准状况下,22.4 L CO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1mol FeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 100ml 1mol/L的FeCl3溶液中Fe3+数目为0.1NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化和被还原的元素分别为铜和氮 | |
| B. | 当产生0.2mol气体时,转移电子为0.6mol | |
| C. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ | |
| D. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com