
【题目】现有下列物质
①NaCO310H2O 晶体 ②铜 ③浓硫酸 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 固体 ⑦红褐色的 氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质属于强电解质的有___________________(填编号)。
(2)上述物质中有两种在水溶液中可发生离子反应:H+ +OH﹣=H2O,写出对应的化学方程式___________________________________。
(3)⑩可以作净水剂,请用离子方程式解释其原因_____________。17.1g的⑩溶于水配成 250mL 溶液,![]() 的物质的量浓度为______________。
的物质的量浓度为______________。
(4)将⑥的溶液滴加到⑤的溶液中至恰好沉淀,发生反应的离子方程式_____________________。
(5)②与⑨发生反应的化学方程式为 ![]() 。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
【答案】①⑤⑥⑩ 2HNO3 + Ba(OH)2= Ba(NO3)2 + 2H2O ![]() 0.6 mol/L H++ SO42-+ Ba2++ OH-=BaSO4↓+ H2O 4.48
0.6 mol/L H++ SO42-+ Ba2++ OH-=BaSO4↓+ H2O 4.48
【解析】
(1)①⑤⑥⑩溶于水的部分或者熔融状态时,可以完全变成阴、阳离子,属于强电解质,故答案为:①⑤⑥⑩;
(2)强酸与强碱反应生成可溶性盐和水的离子反应为H++OH-=H2O,如2HNO3+Ba(OH)2═Ba(NO3)2+2H2O,故答案为:2HNO3+Ba(OH)2═Ba(NO3)2+2H2O;
(3)Al2(SO4)3中的铝离子水解得到的氢氧化铝具有净水作用,即Al3++3H2OAl(OH)3(胶体)+3H+;17.1g的⑩Al2(SO4)3溶于水配成250mL溶液,SO4的物质的量浓度为 =0.6mol/L;故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;0.6mol/L;
=0.6mol/L;故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;0.6mol/L;
(4)将⑥Ba(OH)2的溶液滴加到⑤NaHSO4的溶液中,则硫酸根和氢离子之间按照1:1进行反应至恰好沉淀,发生的反应为:H++SO42-+Ba2++OH-═BaSO4↓+H2O;故答案为:H++SO42-+Ba2++OH-═BaSO4↓+H2O;
(5)反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,产生2molNO同时会伴随6mol电子转移,当有0.6mol电子转移时,生成的气体为0.2mol,即标准状况下的体积为4.48L.故答案为:4.48。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 若反应X + Y = M是放热反应,该反应一定不用加热。
B. 需要加热方能发生的反应一定是吸热反应。
C. 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
D. CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2溶液、盐酸和K2CO3溶液。三种试剂,按下图步骤操作,下列说法错误的是( )
![]()
A.A物质是Ba(OH)2 溶液,为了除尽Mg2+和SO42-
B.B物质是碳酸钠溶液,为了除尽过量的Ba2+
C.C物质是稀盐酸 ,除去过量的CO32-
D.为了除去过量的稀盐酸,加热煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )

A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H1=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为__________________。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为_______。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应的化学方程式为_______。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:

①该反应的最佳条件为:投料比[n(H2O)/n(COS)]__________,温度__________。
②P点对应的平衡常数为_____________ 。(保留小数点后2 位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池如图所示,电池总反应为:
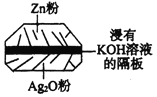
Zn + Ag2O + H2O = 2Ag + Zn(OH)2。下列叙述中正确的是( )
A.在使用过程中,电解质KOH不断被消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.正极反应式为:Ag2O+H2O+2e- = 2Ag+2OH-
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法制备碳酸氢钠的原理为NH3+H2O+CO2 +NaCl=NH4Cl+NaHCO3↓,某化学小组用如图装置在实验室中模拟该制备过程,下列说法不正确的是
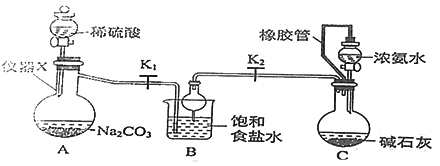
A. 装置A中仪器X的名称为蒸馏烧瓶
B. 装置B中球形干燥管的作用是防止倒吸
C. 装置C中橡胶管的作用是平衡压强,使溶液顺利滴下
D. 实验开始后,应先打开K1一段时间,然后再打开K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应Na2Sx与 NaClO的物质的量之比为1∶16,则x的值为_________。
(2)实验室制取氯气,将多余的氯气用100 mL 1.7mol/LNaOH溶液完全吸收。对吸收后溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化),ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
①被还原的氯气的物质的量为 _______________mol。
②若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )

A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com