
【题目】普通锌锰干电池的构造如图所示,其电池反应的方程式为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)下列说法不正确的是( )

A.石墨作正极
B.锌发生氧化反应
C.电池工作时,电子从石墨经导线流向锌
D.正极的电极反应为:NH4++MnO2+e-=MnO(OH)+NH3
【答案】C
【解析】
分析电池反应方程式可知,Zn化合价升高,被氧化,发生氧化反应,MnO2化合价降低,被还原,发生还原反应。根据原电池中,负极发生氧化反应,正极发生还原反应,电子由负极经导线流向正极,电流与电子移动方向相反。据此分析解答。
A.根据原电池中一般活泼金属作负极,活泼性较弱的金属或非金属作正极,结合原电池的总反应式可知,石墨作正极,A项正确;
B.根据题中电池反应方程式可知,Zn化合价升高,被氧化,发生氧化反应,B项正确;
C.原电池中,电子从负极经导线流向正极,在该普通锌锰干电池中,Zn作负极,石墨作正极,电子应从Zn极经导线流向石墨,C项错误;
D.正极发生还原反应,其电极反应方程式为:NH4++MnO2+e-=MnO(OH)+NH3,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。

(1)仪器B的名称为_____,由仪器B的使用可知SO2与Cl2反应的ΔH____(填“>”或“<”)0。
(2)仪器C的作用是________________________________。
(3)试剂X、Y的组合最适宜的是______。
a.18.4mol/LH2SO4溶液+Cu b.4mol/LHNO3溶液+Na2SO3 c.75%H2SO4溶液+K2SO3
(4)反应结束后,将丙中产物分离的实验操作的名称是______。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色溶液w。
①写出该反应的离子方程式:___________。
②检验溶液w中存在SO42-的方法是________。
(6)若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是( )

A. 含16g氧原子的二氧化硅晶体中含有的σ键数目为2NA
B. 58.5g NaCl晶体中含有0.25NA个如图所示的结构单元
C. 含1mol水分子的冰晶体中氢键数为4NA
D. 常温常压下,5g2D2O含有的质子数、电子数、中子数均为2.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期及其中的部分元素,请回答相关问题

(1)a、f、g元素最高价氧化物的水化物碱性由强到弱的顺序是____(用化学式表示)。
(2)氢元素可与其它元素形成_____(填选项序号)等化学键。
A.极性共价键 B.非极性共价键 C.氢键 D.离子键
(3)d、f、h三种元素可形成一种有强还原性的化合物,该化合物中含有非极性键,其化学式为_____,向该化合物的水溶液中加入盐酸发生自身歧化反应的离子方程式为______。
(4)表中所给的某两种元素可形成一种常见的有机溶剂,可用于萃取碘水中的碘单质,萃取后有机层的颜色为______,分液时有机层应从______(填“下口流出“或“上口倒出”)。该有机溶剂的电子式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池放电时的反应为3CO2+4Na=2Na2CO3+C,下列说法正确的是
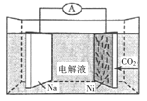
A.负载碳纳米管的镍网为电池的负极
B.充电时电池将化学能转化为电能
C.放电时,正极反应为:3CO2+4e=2CO32-+C
D.放电时Na+移向电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于P区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2中阴阳离子个数比不同
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: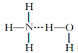
⑦HF晶体沸点高于HCl,是因为 HCl共价键键能小于HF
A. 4项B. 5项C. 6项D. 7项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有的电子数为10NA
B.NO2和N2O4混合气体共46 g,所含原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g 14C所含原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com