
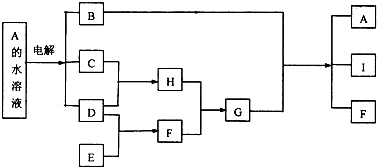
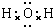 ;
;分析 化合物A的焰色反应显黄色,C、D、E是气态单质,A电解生成C、D,所以A应为NaCl,所以B为NaOH,C、D为Cl2和H2,C和D反应生成H为HCl,F、H在通常状况下反应产生大量白烟,则F是NH3,G为NH4Cl,氢氧化钠与氯化铵反应生成I为H2O,E和D反应生成F,所以E为N2,以NH3、空气和水为原料经过一系列的化学反应可以合成酸M为HNO3,据此答题.
解答 解:化合物A的焰色反应显黄色,C、D、E是气态单质,A电解生成C、D,所以A应为NaCl,所以B为NaOH,C、D为Cl2和H2,C和D反应生成H为HCl,F、H在通常状况下反应产生大量白烟,则F是NH3,G为NH4Cl,氢氧化钠与氯化铵反应生成I为H2O,E和D反应生成F,所以E为N2,以NH3、空气和水为原料经过一系列的化学反应可以合成酸M为HNO3,
(1)I为H2O,I的电子式为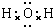 ,
,
故答案为: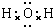 ;
;
(2)电解NaCl溶液的离子反应方程式为 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)M为HNO3,M的浓溶液与铜反应的化学方程式为Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)Mg(OH)2饱和溶液中的c(OH-)=$\sqrt{\frac{Ksp[Mg(OH){\;}_{2}]}{c(Mg{\;}^{2+})}}$=$\sqrt{\frac{1.8×10{\;}^{-11}}{0.18}}$mol/L=1×10-5 mol/L,则溶液的pH是9,
故答案为:9.
点评 本题是一道典型的无机框图推断题,为高考常见题型,侧重于考查对元素化合物基础知识的掌握,还主要考查学科内知识间的综合推理能力,难度中等,突破口为:A的焰色反应显黄色,F、H是气态化合物在通常状况下反应产生大量白烟,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 82克O2所含有的原子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
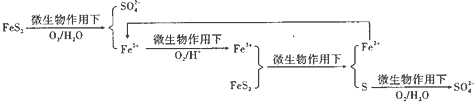
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 金属元素与非金属元素能形成共价化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
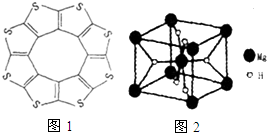 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.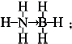 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
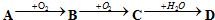
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com