
【题目】化学与生活、生产、科研密切相关,请根据所学知识回答:
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____。
(2)B为0.1mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:___。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入___,目的是___;
(4)若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
【答案】c(NH4+)>c(SO42-)>c(H+)>c(OH-) 在碳酸氢钠溶液中水解程度大于电离程度,HCO3-+H2O![]() H2CO3+OH-水解显碱性 盐酸 抑制Fe3+水解 Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
H2CO3+OH-水解显碱性 盐酸 抑制Fe3+水解 Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
【解析】
(1)NH4+水解使溶液呈酸性,但水解程度微弱;
(2)测得NaHCO3溶液的pH>7,从弱酸的阴离子水解的角度分析;
(3)Fe3+易水解,离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解;
Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解;
(4)把B和C溶液混合,Fe3+和HCO3-发生双水解,生成红褐色沉淀和无色气体。
(1)NH4+水解使溶液呈酸性,c(H+)>c(OH-),由于NH4+水解程度微弱,因此在该溶液中各种离子的浓度由大到小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)在碳酸氢钠溶液中水解程度大于电离程度,HCO3-水解方程式为HCO3-+H2O![]() H2CO3+OH-,HCO3-水解使溶液显弱碱性,溶液的pH>7;
H2CO3+OH-,HCO3-水解使溶液显弱碱性,溶液的pH>7;
(3)Fe3+易水解,离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解,因此配制FeCl3溶液时通常需要向其中加入盐酸;
Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解,因此配制FeCl3溶液时通常需要向其中加入盐酸;
(4)把B和C溶液混合,Fe3+和HCO3-发生双水解,生成红褐色沉淀和无色气体,离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。________
⑶ 假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图)。

(1)碳酸钙完全反应用去稀盐酸的质量为__________g。
(2)该石灰石样品中碳酸钙的质量分数为_________。
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 常温下pH=7的溶液中:Fe3+、NO![]() 、Al3+、Cl-
、Al3+、Cl-
B. 水电离的c(H+)=1×10-13mol·L-1的溶液:Na+、NH4+、SO![]() 、CO
、CO![]()
C. 含有0.1mol·L-1Ca2+的溶液中:Na+、Cu2+、SiO![]() 、NO
、NO![]()
D. 含有大量NO![]() 的溶液:K+、Fe2+、SO
的溶液:K+、Fe2+、SO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精细化工在生产和生活中有广泛而重要的应用。
(1)精细化学品往往有特定的功能从而广泛地应用于日常生活中,下列洗涤方法原理各不相同,请比较
①沾有油脂的器皿可用汽油擦洗,其原理是________;
②也可用洗洁精和水洗涤,其原理是_______;
③还可以用纯碱或稀氢氧化钠溶液洗涤,其原理是___________。
④如果水溶液的硬度很大,用肥皂与合成洗涤剂哪个洗涤剂效果更好?为什么? ____。
(2)据报道,我国某地发生误食工业用猪油的中毒事件,原因是工业品包装中混入有机锡等,下列有关叙述正确的是__________。
A.猪油是天然高分子化合物
B.猪油是高级脂肪酸甘油酯
C.猪油发生皂化反应后,反应液能使蓝色石蕊试纸变红
D.猪油皂化反应完全后,反应混合物静置后分为两层
(3)阿司匹林是一种常用的药剂,其化学名称为乙酰水杨酸,其分子结构如图:
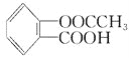
阿司匹林的一种同分异构体中含有苯环和两个羧基,且苯环上只有一个侧链,则阿司匹林的这种同分异构体的结构简式为____________。以苯酚为原料合成水杨酸,为阿司匹林的大量生产开辟了广阔的前景,其生产阿司匹林的流程如下:
![]()
![]()
![]() 水杨酸
水杨酸![]() 阿司匹林
阿司匹林
写出反应②的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同带活塞的容器,分别盛装一定量的颜色相同的NO2(g)和Br2(g),迅速将两容器同时压缩到原来的一半(假设气体不液化),下列说法正确的是( )
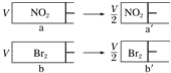
A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B.a′,b′的颜色一样深
C.a′的压强比a的压强2倍要小,b′的压强为b的压强的2倍
D.a′中的c(NO2)一定比b′中的c(Br2)小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com