
| A. | 8 | B. | 10 | C. | 14 | D. | 30 |
科目:高中化学 来源: 题型:填空题
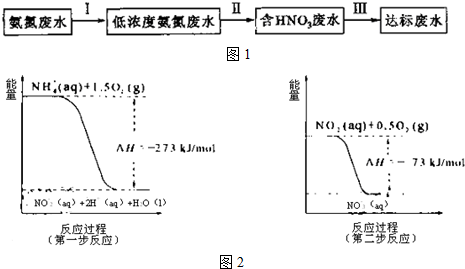
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
| A. | 0~2min H2O2平均反应速率比4~6min慢 | |
| B. | 反应至6min时,共产生O244.8L | |
| C. | 0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol•L-1•min-1 | |
| D. | 反应至6min时,c(H2O2)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧方框内的产物是OH- | |
| C. | 10mol H+参加反应时,电子转移5mol | |
| D. | 1mol草酸分子中含有9mol共用电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | X与Y同主族,相同温度时,二者的单质与铜反应分别生成Cu2X CuY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol固体氢氧化钠的体积比1mol氢气的体积小 | |
| B. | NA个氧气分子和NA个氢气分子的质量比为16:l | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | NA个H2SO4分子中所含氧原子个数与4NA个H2O分子中所含氧原子个数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的冶炼、电镀、燃料的燃烧、食物的腐败、钢铁的锈蚀等均属于氧化还原反应 | |
| B. | 将铁片投入硫酸铜溶液中所发生的置换反应既属于氧化还原反应,又属于离子反应 | |
| C. | 有单质参与的化学反应一定是氧化还原反应 | |
| D. | 氧化还原反应一定发生电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: ,元素D位于元素周期表的第ⅥA族.
,元素D位于元素周期表的第ⅥA族. +2
+2 →
→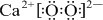 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com