
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.0.5mol/L Na2SO4溶液中所含Na+数目为1NA
B.标况下,NA个N子的体积约为22.4L,则1个N子的体积为10/NA L
C.0.5mol NaCl晶体中约含有6.02×1023个离子
D.22.4L CO2气体中含有3NA个原子
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列说法中正确的是
①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL0.1 mol/LFeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01 NA
④在反应KIO3 + 6HI==KI+ 3I2+3H2O中,每生成6 mol I2转移的电子数为10 NA
⑤电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜.
A.①⑤ B.③④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一12月月考化学试卷(解析版) 题型:选择题
把CO2通入NaOH溶液中,当生成Na2CO3和NaHCO3的物质的量之比为2:1时,CO2和NaOH的物质的量之比为( )
A.3:2 B.3:4 C.3:5 D.1:2
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因_____________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的作用是_________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。向饱和NaClO溶液中加入饱和KAl(SO4)2溶液,产生 大量的白色胶状沉淀。反应的离子方程式是_______________________。
大量的白色胶状沉淀。反应的离子方程式是_______________________。
(4)常温下,pH=11的NaClO溶液中,水电离出来的c(OH-)=________,在pH=3的HClO溶液中,水电离出来的c(H+)=____________________________。
(5)已知纯水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所
H3O++OH- ΔH>0,现欲使平衡向右移动,且所 得溶液显酸性,可选择的方法是________(填字母)。
得溶液显酸性,可选择的方法是________(填字母)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(6)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
(7) 在25 ℃时,将0.2 mol NaA晶体和0.1 mol HA气体同时溶解于同一烧杯的水中,制得1 L溶液,则c(HA)+c(A-)= mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:填空题
[化学------选修3:物质结构与性质]
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,
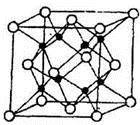
则图中黑球代表的离子是_________(填离子符号),该离子的配位数为 。该晶胞参数a="b=c=d" pm ,列式计算R2M晶体的密度为 g/cm³。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:选择题
下列实验操作和数据记录都正确的是( )
A. 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
C. 用干燥的广泛pH试纸测稀盐酸的pH=3.2
D. 用10 mL量筒量取NaCl溶液,体积为9.2 mL
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是
A.FeS2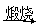 SO3
SO3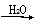 H2SO4
H2SO4
B.NaCl(aq) Na
Na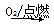 Na2O2
Na2O2
C.Fe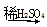 FeSO4(aq)
FeSO4(aq)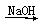 Fe(OH)2
Fe(OH)2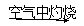 Fe2O
Fe2O 3
3
D.Fe2O3 FeCl3(aq)
FeCl3(aq) 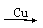 Fe
Fe
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学卷(解析版) 题型:填空题
在铁和氧化铁的混合物 15 g 中加入150 mL 稀 H2SO4 放出氢气 1.68 L(标准状况下)。当反应停止后,铁与氧化铁均无剩余,且溶液中没有 Fe 3+存在。为了中和过量 H2SO4,并使 Fe 2+ 完全转化为 Fe(OH) 2沉淀,共耗用 3 mol·L-1 NaOH 溶液 200 mL。
(1) 写出溶液中反应的化学方程式:___________________;__________________;_________________。
(2) 混合物中铁的质量为______________,氧化铁的质量为______________。
(3) 稀 H 2 SO 4的物质的量浓度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com