
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。
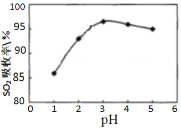
(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
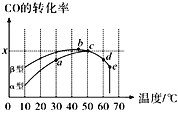
(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
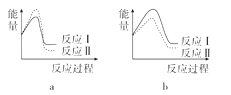
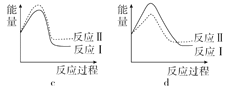
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
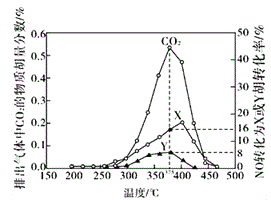
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。
【答案】3 氧化剂 MnCO3+H2SO4== MnSO4+CO2↑+H2O > > 温度升高后催化剂失去活性 a 2NO(g)===1/2N2(g)+NO2(g) ΔH=(a-b) kJ·mol-1 N2O 因常温下有2NO2![]() N2O4会导致一定的分析误差
N2O4会导致一定的分析误差
【解析】
本题主要考察了氧化还原反应原理,热反应方程式书写,催化剂性质和化学平衡常数与转化率性质。
(1)由题可知,SO2的吸收率在pH=3时效果最佳;软锰矿(MnO2)吸收SO2制取硫酸锰MnO2,二氧化硫发生氧化反应,故MnO2所起的作用是氧化剂,菱锰矿与硫酸反应,确保pH的稳定,该反应的化学方程式为. MnCO3+H2SO4== MnSO4+CO2↑+H2O;
(2)由图可知,温度升高,CO转化率减小,反应逆向移动,故a温度低于c,K(a)>K(c);可逆反应达到平衡时,转化率最大,故图中b、c点到达平衡,在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率大于α型;反应过程存在催化剂,故e点转化率出现突变的原因可能是温度升高后催化剂失去活性;
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅰ的活化能小于反应Ⅱ的活化能,且0>a>b则示意图正确的是a;
(4)根据盖斯定律,反应①-反应②:2NO(g)===1/2N2(g)+NO2(g) ΔH=(a-b) kJ·mol-1;
(5)模拟尾气中NO的物质的量是0.025mol,而图中参与反应生成的X和Y的NO的物质的量是0.025mol×(8%+16%)=0.006mol,模拟尾气中的氧气物质的量是0.5mol,测得排出的气体中含有0.45mol的氧气,说明实际参与反应的氧气的物质的量为0.05mol,同时测得0.0525mol二氧化碳。根据氧守恒可知,N2O的物质的量是0.05×2+0.06-0.0525×2=0.001mol,根据氮守恒可知,N2的物质的量是0.003-0.001=0.002mol,所以16%对应的是氮气,8%对应的是N2O,故Y是N2O;
(6)实验过程中不采用NO2的模拟NOx原因是存在双聚平衡2NO2![]() N2O4,所以无纯的二氧化氮。
N2O4,所以无纯的二氧化氮。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )
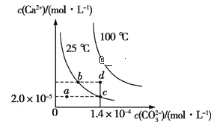
A.CaCO3(s)![]() Ca2+(aq)+CO32-(aq) ΔH<0
Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时, Ksp (AgCl)= 1.56×10-10, Ksp(Ag2CrO4)= 9.0×10-12,下列说法正确的是
A. AgCl 和 Ag2CrO4 共存的悬浊液中,![]()
B. 向Ag2CrO4悬浊液中加入 NaCl 浓溶液, Ag2CrO4不可能转化为 AgCl
C. 向 AgCl 饱和溶液中加入 NaCl 晶体, 有 AgC1 析出且溶液中 c(Cl-)=c(Ag+)
D. 向同浓度的 Na2CrO4和 NaCl 混合溶液中滴加 AgNO3溶液,AgC1先析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下:
![]()
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述反应中只有③属于氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
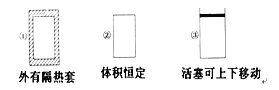
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:

(1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。
(2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。
(4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
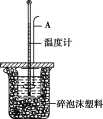
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法正确的是
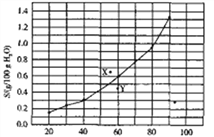
A. 溴酸银的溶解是一个熵增、焓减过程
B. 对应温度下,X点的分散系中,V(溶解)>v(沉淀)
C. Y点的分散系中,c(Ag+)·c(BrO3-)>6.25×10-4
D. 60 ℃时溴酸银饱和溶液中c(BrO3-)=0.025mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的O2和NH3混合成448 mL,通过预先加热的催化剂三氧化二铬充分反应后,再通过足量的水,最终收集到44.8mL的无色气体。则原混合气体中O2的体积可能是(氨全部被氧化;气体体积均已换算成标准状况)( )
A. 231.5 mLB. 268.8 mLC. 287.5 mLD. 56 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com