
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等 |
分析 A、求出镁的物质的量,然后根据镁反应后变为+2价来分析;
B、盐酸溶液体积不明确;
C、求出甲烷和水的物质的量,然后根据甲烷和水均为10电子微粒来分析;
D、CO所处的状态不明确.
解答 解:A、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁失去0.2NA个电子,故A错误;
B、盐酸溶液体积不明确,故溶液盐酸溶液中的粒子个数无法计算,故B错误;
C、标况下22.4L甲烷和18g水的物质的量均为1mol,而甲烷和水均为10电子微粒,故1mol甲烷和1mol水中均含10NA个电子,故C正确;
D、CO所处的状态不明确,故CO的物质的量无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | v (A)=0.36mol•L-1•s-1 | B. | v (B)=0.55mol•L-1•s-1 | ||
| C. | v (C)=0.40mol•L-1•s-1 | D. | v (D)=0.48mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
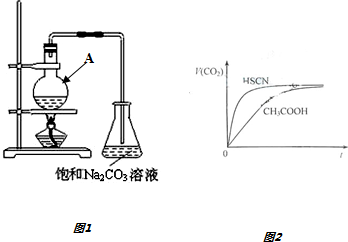
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
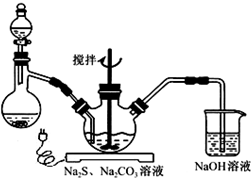 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO21 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
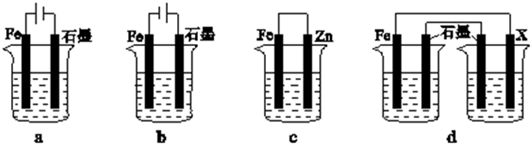
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com