
| A. | Na+物质的量浓度为0.2mol/L | B. | 溶液中含1mol NaOH | ||
| C. | 溶液中含4gNaOH | D. | 物质的量浓度为0.2 mol/L |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们使用合金是因为它比纯金属具有更优良的机械性能 | |
| B. | 钢化玻璃、有机玻璃、石英玻璃均属于硅酸盐材料 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.5mol | C. | 0.15mol | D. | 0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 升温能使反应物活化分子的百分数增加,所以提高尾气净化效率还需要升高温度 | |
| C. | 提高尾气净化效率的最佳途径是研制高效催化剂 | |
| D. | 因该反应正向进行的程度已经很大,故使用催化剂并无实际意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
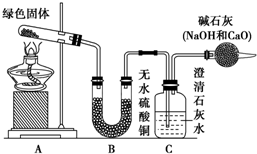 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有甲酸乙酯和甲酸 | B. | 有甲酸乙酯和乙醇 | ||
| C. | 有甲酸乙酯,可能有乙醇 | D. | 几种物质都有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、HCO3-、SO42- | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Mg2+、Na+、SO42-、NO3- | D. | Al3+、Ag+、OH-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
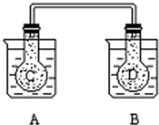 如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00
如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com