
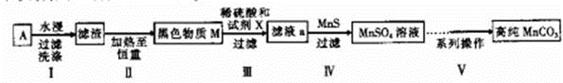
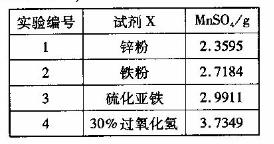
 ���Ҵ���
���Ҵ���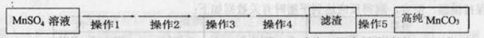



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������Һ�м���������ˮ��ȡ���屽�Ӱ�ɫ���� |
| B���ø��������Һ��ȥ��ϩ�л��е�����SO2 |
| C����ˮ����������ɫҺ�壺�����Ҵ������Ȼ�̼ |
| D���������ķ��������Ҵ����е�78.5�棩�����ѣ��е�34.5�棩 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ȡ������Ʒ�����Թ��У����ȣ��Թܿڷ�һ��պ����ˮ����ͭ��ĩ�����ţ��������֤������ijɷ��к��нᾧˮ |
| B��ȡ������Ʒ����ˮ���õ���ɫ��Һ������2��KSCN��Һ����Һ���Ժ�ɫ���ٵ��뼸��������ˮ����Һ��Ϊ��ɫ�����֤������ijɷ��к���Fe2+ |
| C��ȡ������Ʒ����ˮ��������ϡ���ᣬ�������ٵ��뼸��BaCl2��Һ���а�ɫ�������ɣ����֤������ijɷ��к���SO42- |
| D��ȡ������Ʒ�����Թ��У���������ϡNaOH��Һ�����Թܿ���ʪ��ĺ�ɫʯ����ֽ���飬���֤������ijɷ����Ƿ���NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ���ʳɷ֣�������Ϊ���ʣ� | �����Լ� | ���� |
| A | ��м�����ۣ� | ������Һ | ϴ�� |
| B | �������ӣ� | ��ˮ | ���� |
| C | ̼�ᱵ�����ᱵ�� | ���� | �ܽ⡢���� |
| D | �Ҵ������ᣩ | �ռ���Һ | ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
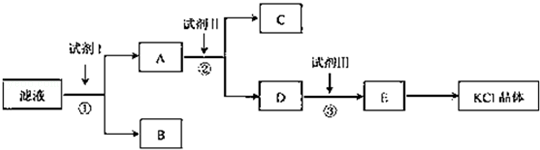
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| | ʵ��Ŀ�� | ʵ����� |
| A | ����CO32-�� SO42- | �ֱ���뱥��CaCl2��Һ |
| B | �Ƚ�Al��Fe�Ľ������ | �ֱ����ŨNaOH��Һ |
| C | �Ƚϱ��Ӻ���������� | �ֱ����NaHCO3��Һ |
| D | �Ƚ�AgCl��AgI���ܽ�� | ��AgCl�ı���Һ�м�����KI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | պ��Ũ��ˮ�IJ�����������ҺX | �а��̲��� | Xһ����Ũ���� |
| B | ij����W�м���ϡ���ᣬ��������ɫ��ζ������ͨ�����ʯ��ˮ | ʯ��ˮ����� | Wһ����Na2CO3 |
| C | ǿ������ҺY�м���Ba(NO3)2��Һ�����ú��ټ���KSCN��Һ | ���а�ɫ������ ����Һ�ֱ�� | Y��һ������SO42����Fe3+ |
| D | ������̬Ȳ��Zͨ��pH=a����ˮ�� | ��ˮ��ɫ����Һ��pH��ԼΪa | Z���巢���˼ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

| A��CCl4 | B��H2O | C��NH4Cl��Һ | D��ֲ���� |
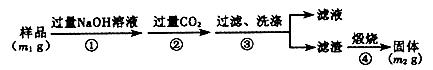
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
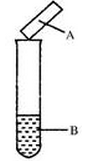
| ѡ�� | �Լ�B | ʪ��� ��ֽA | ���� | ���� |
| A | ��ˮ | ������ֽ | ���� | ����������� |
| B | Ũ��ˮ����ʯ�� | ��ɫʯ����ֽ | ��� | ����Ϊ�������� |
| C | Na2SO3������ | Ʒ����ֽ | ��ɫ | SO2����Ư���� |
| D | Cu��Ũ���� | KI������ ��ֽ | ���� | NO2Ϊ �������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com