
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
解析 A项烧碱是NaOH而不是Na2CO3,并且Na2CO3为强碱弱酸盐,其溶液因CO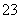 发生水解反应而显碱性,油脂在碱性溶液中发生水解反应,生成易溶于水的高级脂肪酸盐和甘油,并非Na2CO3直接与油脂发生反应。
发生水解反应而显碱性,油脂在碱性溶液中发生水解反应,生成易溶于水的高级脂肪酸盐和甘油,并非Na2CO3直接与油脂发生反应。
B项酸与盐发生复分解反应符合“较强酸制取较弱酸”的规律,HCl、H2CO3和HClO的酸性强弱顺序为HCl>H2CO3>HClO,因此漂白粉发生变质时,Ca(ClO)2与空气中的CO2、H2O(g)反应生成CaCO3和HClO,HClO再分解为HCl和O2,而CaCl2与空气中的CO2不能发生反应。C项K2CO3为强碱弱酸盐,NH4Cl为强酸弱碱盐,草木灰与NH4Cl混合使用时,CO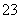 与NH
与NH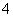 发生水解相互促进反应生成NH3,降低肥效。D项FeCl3溶液可用于制造铜质印刷线路板,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2,Fe3+将Cu氧化为Cu2+,并非发生置换反应。
发生水解相互促进反应生成NH3,降低肥效。D项FeCl3溶液可用于制造铜质印刷线路板,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2,Fe3+将Cu氧化为Cu2+,并非发生置换反应。
答案 C


科目:高中化学 来源: 题型:
下列关于某些社会热点问题的说法中,不正确的是( )
A.禁用含铅汽油是为了提高汽油的燃烧效率
B.甲醇含量超标的酒绝对不能饮用
C.甲醛是某些劣质装饰材料释放的常见室内污染物之一
D.氟氯烃对大气臭氧层具有破坏作用
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温下的密闭容器中,有可逆反应2NO2N2O4,下列描述不能说明反应达到平衡状态的是( )
A.N2O4生成速率与N2O4分解速率相等
B.混合气体平均相对分子质量保持不变
C.NO2的分子数与N2O4分子数之比为2:1
D.体系颜色不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO 4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线如图所示,结合各反应的ΔH,归纳lgK-T曲线变化规律:
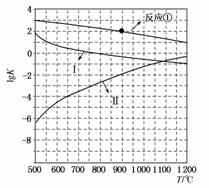
a)__________________________________________________________;
b)_________________________________________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5 mol·L-1,计算CO的转化率________(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________________________________________________________________________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原 因是发生了
因是发生了 如下反应:CH3COO-+H2OCH3COOH+OH-使得溶液中的c(OH-)>c(H+)
如下反应:CH3COO-+H2OCH3COOH+OH-使得溶液中的c(OH-)>c(H+)
B.将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-)
C.在0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO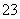 )+c(HCO
)+c(HCO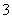 )
)
D.在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH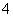 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO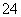 、NO
、NO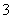 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO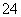 、NO
、NO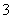
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生产、生活密切相关,下列说法正确的是 ( )
A.澳大利亚学者研究发现,夏季给鸡喂食碳酸水会使蛋壳变厚
B.陶瓷、水泥及所有玻璃都是硅酸盐产品
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.Cl2有漂白性,所以用Cl2可与石灰乳反应制备含氯消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A(g)+3B(g)  2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A、v(A)=0.01 mol/(L•s) B、v(B)=0.02 mol/(L•s)
C、v(B)=0.60mol/(L•min) D、v(C)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
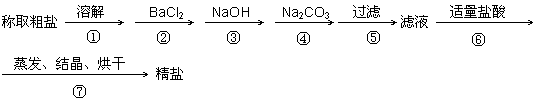
(1)判断BaCl2已过量的方法是 。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若先用盐酸再过滤,将对实验结果产生影响,其原因是
(4)在“粗盐提纯”的实验中,多次用到玻璃棒,在溶解、过滤、蒸发三个步骤中都用到玻璃棒,请写出步骤⑦使用到玻璃棒的作用__________ __
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com