
| A. | 2SO2(g)+O2(g)?2SO3(g)(正反应是放热反应) | |
| B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)(正反应是放热反应) | |
| C. | 2NH3(g)?N2(g)+3H2(g)(正反应是吸热反应) | |
| D. | SO2(g)+NO2(g)?SO3(g)+NO(g)(正反应是放热反应) |
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI的酸性溶液长期置于空气中:4I-+2H2O+O2═2I2+4OH- | |
| B. | 高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| C. | 用稀硫酸除去铁片表面的铁锈:FeO+2H+═Fe2++H2O | |
| D. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
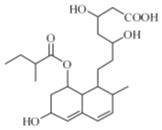
| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可消耗4molNaOH、2molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 某实验需要配制460mL1.0mol/L的稀硫酸,应取该硫酸25.0mL | |
| B. | 足量铜和含2mol溶质的该硫酸在加热条件下反应,标准状况下生成气体的体积约为22.4L | |
| C. | 该硫酸与等质量的水混合所得溶液溶质的物质的量浓度小于9.2mol/L | |
| D. | 该硫酸与等体积的水混合所得溶液的溶质质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体、尿素、冰水混合物 | B. | 乙醇、浓硫酸、胆矾 | ||
| C. | 金刚石、铁矿石、大理石 | D. | 水银、水蒸气、生铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
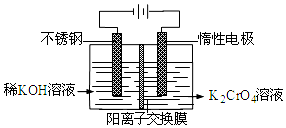
| A. | 在阴极式,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 铬原子的价电子排布式为3d44S2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com