
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如图:
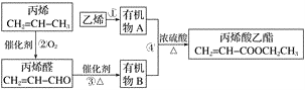
根据以上材料和你所学的化学知识,回答下列问题:
(1)乙烯的电子式是_____,官能团的名称是______。
(2)除去甲烷中的乙烯所用的试剂是____(填序号)。
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(3)反应①的化学方程式是______,反应类型是_____。
(4)反应④的化学方程式是______,反应类型是_____。
【答案】![]() 碳碳双键 B CH2=CH2+H2O
碳碳双键 B CH2=CH2+H2O![]() CH3CH2OH 加成反应 CH2=CHCOOH+CH3CH2OH
CH3CH2OH 加成反应 CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O 酯化反应或取代反应
CH2=CHCOOCH2CH3+H2O 酯化反应或取代反应
【解析】
丙烯氧化为丙烯醛,丙烯醛再氧化为丙烯酸(B),制丙烯酸乙酯的原料是丙烯酸和乙醇,所以乙烯和水加成生成乙醇(A),乙醇和丙烯酸发生酯化反应生成丙烯酸乙酯。
(1)乙烯的电子式是![]() ,官能团是碳碳双键。
,官能团是碳碳双键。
(2)乙烯可以和溴发生加成反应,所以可以用溴的四氯化碳溶液除去甲烷中的乙烯。虽然乙烯也可以和酸性高锰酸钾溶液反应,但乙烯被氧化为二氧化碳,会引入新杂质,所以不能用酸性高锰酸钾溶液除去甲烷中的乙烯。乙烯不能和在常温下和水反应,也不能和稀硫酸反应,所以除去甲烷中的乙烯所用的试剂是溴的四氯化碳溶液。故选B。
(3)反应①是乙烯和水加成制取乙醇,化学方程式是CH2=CH2+H2O![]() CH3CH2OH ,反应类型是加成反应。
CH3CH2OH ,反应类型是加成反应。
(4)反应④是乙醇和丙烯酸发生酯化反应生成丙烯酸乙酯,化学方程式是CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O ,反应类型是酯化反应,也是取代反应。
CH2=CHCOOCH2CH3+H2O ,反应类型是酯化反应,也是取代反应。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是( )
2C(气)+2D(固)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦A、B、C、D的分子数之比为1:3:2:2
A.②⑦B.②⑤⑦C.①③④D.②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验合理的是


A. 配置一定浓度的硫酸 B. 制备少量氨气
C. 制备并收集少量NO2气体 D. 制备少量氧气,并随关随停
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
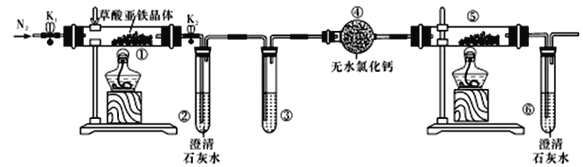
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 通入N2的主要目的是防止空气中的CO2对产物检验产生影响
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉未完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是______________.
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
①写出NO2和SO2反应的热化学方程式为_________.
②随温度升高,该反应化学平衡常数变化趋势是_____.
(3)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是____.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____(填字母).
a.温度和容器体积不变,充入1.0mol He b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。

①电解饱和食盐水的化学方程式是________________.
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_________.
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体
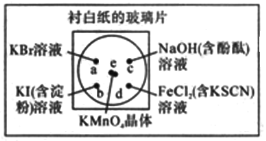
(1)①写出化学实验室中用MnO2制取Cl2的化学方程式______________________________。
②完成本实验中制取Cl2的化学方程式:
___________KMnO4+__________HCl(浓)——______KCl+________MnCl2+____Cl2↑+______ _______
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为_________________。
(2)b处的实验现象为____________________________________________________。
c处的实验现象为____________________________________________________。
(3)d处反应的离子方程式为____________________、____________________。
(4)通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及他物质已经略去);![]()
Ⅰ. 若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为__________________________,体现B的_____________(选填 “氧化性”“还原性”“漂白性”)
(2)98%的浓硫酸改为氧化物形式SO3·nH2O,则n值为_________(可写成分数形式)
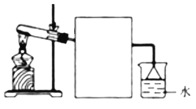
Ⅱ.若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出写出A→B的化学方程式_____________________________________________。
(2)实验室常用右图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图________。
(3)尾气处理装置中使用倒扣漏斗的作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞中溶有碳酸氢钙的水,当从洞顶向洞底滴落时,水分的蒸发、压强的减小及温度的升高都会析出碳酸钙沉淀。下列实验不能实现碳酸氢钙转化为碳酸钙的是( )
A.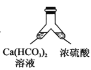 B.
B.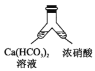 C.
C.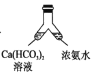 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2—二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
___________________________________________________________
___________________________________________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com