
A.合成氨反应:N2(g)+3H2(g) 2NH3(g) ;△H<0,为使氨的产率提高,理论上应采取低温高压的措施 2NH3(g) ;△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
B.对2HI(g) H2(g)+I2(g)平衡体系增加压强使颜色变深 H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| C.使用催化剂有利于提高SO2与O2生成SO3的效率 | D.用排饱和氯化钠溶液的方法来收集氯气 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:不详 题型:单选题
| A.2.5 mol | B.4.5 mol | C.5mol | D.7.5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨工业采用高温条件 |
| B.配制FeSO4溶液时在溶液中加入稀硫酸 |
| C.H2、I2、HI 平衡混合气体加压后颜色变深 |
| D.工业制硫酸中,SO2氧化成SO3,往往需使用催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
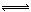 2CO(正反应吸热),反应速率为v1:N2+3H2
2CO(正反应吸热),反应速率为v1:N2+3H2 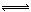 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况是 ( )
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况是 ( )| A.同时增大 | B.同时减小 |
| C.v1增加,v2减小 | D.v1减小,v2增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
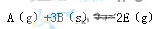 ,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E
,正反应放热。为使平衡状态向生成E的方向移动,适宜的条件是①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E| A.①③⑥ | B.②③⑥ | C.②④⑥ | D.②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
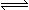 2C(g)若经2 s 后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
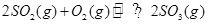 ,从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
,从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是 | A.新平衡体系中,SO2和O2物质的量之比仍为2∶1 |
| B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了 |
| C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了 |
| D.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(气) △H﹤0正确的说法是
2C(气) △H﹤0正确的说法是| A.增加A的浓度,平衡向右移动,K值增大 |
| B.增加压强,正反应速度增大,逆反应速度减小,平衡向右移动 |
| C.使用正催化剂,化学平衡向右移动 |
| D.降低温度,正逆反应速度都减慢,化学平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
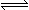 B(气) △H=Q达到平衡时混合气体的平均分子量为M1, t2℃时该反应的平衡混合气体的平均分子量为M2 , 当平衡从t1℃升温至t2℃时,下列说法中正确的是:
B(气) △H=Q达到平衡时混合气体的平均分子量为M1, t2℃时该反应的平衡混合气体的平均分子量为M2 , 当平衡从t1℃升温至t2℃时,下列说法中正确的是:| A.若Q<0,平衡左移,M1>M2 | B.若Q<0,平衡右移, M1<M2 |
| C.若Q>0,平衡左移,M1>M2 | D.若Q>0,平衡右移, M1<M2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com