
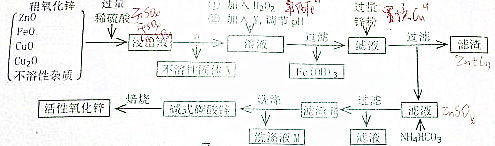
分析 将粗氧化锌溶于过量稀硫酸中,发生的反应为ZnO+H2SO4=ZnSO4+H2O、FeO+H2SO4=FeSO4+H2O、CuO+H2SO4=CuSO4+H2O、Cu2O+H2SO4=CuSO4+Cu+H2O,然后过滤,将不溶性固体除去,向滤液中加入H2O2,发生的离子反应方程式为2Fe2+H2O2+2H+=2Fe3++2H2O,加入Y调节溶液的pH,Y应该能和H+反应且不能引进新的杂质,可以用ZnO或ZnCO3;
将Fe3+转化为Fe(OH)3沉淀,然后采用过滤方法得到Fe(OH)3沉淀,向滤液中加入过量Zn粒,发生的离子方程式为Zn+Cu2+=Cu+Zn2+,然后过滤,得到的滤渣中含有Zn和Cu,滤液中含有ZnSO4,向滤液中加入NH4HCO3,发生双水解反应生成碱式碳酸锌沉淀和硫酸铵溶液,过滤洗涤得到滤渣碱式碳酸锌;将滤渣焙烧得到活性ZnO,
(1)分离难溶性固体和溶液采用过滤方法;除杂时要除去杂质且不能引进新的杂质;
(2)过滤时,根据各仪器的作用选取仪器;
(3)该流程中,滤渣R吸附的离子是硫酸根离子,用盐酸酸化的氯化钡离子检验硫酸根离子,如果最后洗涤液中加入氯化钡溶液后不产生沉淀即可;
(4)Zn(OH)2在水中同时存在两种电离方式:Zn2++2OH-?Zn(OH)2?ZnO2-+H+,Zn(OH)2与NaOH溶液反应生成偏锌酸钠和水;
(5)n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,恰好溶解时消耗氯化氢0.08摩尔,根据关系式2HCl---Zn2+得n(Zn2+)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.08mol=0.04mol,则Zn、C原子个数之比=0.04mol:0.01mol=4:1,
要使碱式碳酸锌化合价的代数和为0,则OH-个数应该是6,碱式碳酸锌为Zn4(OH)6CO3,
水的物质的量=$\frac{4.4g-0.01mol×(65×2+17×6+60)g/mol}{18g/mol}$=0.08mol,
据此确定化学式.
解答 解:将粗氧化锌溶于过量稀硫酸中,发生的反应为ZnO+H2SO4=ZnSO4+H2O、FeO+H2SO4=FeSO4+H2O、CuO+H2SO4=CuSO4+H2O、Cu2O+H2SO4=CuSO4+Cu+H2O,然后过滤,将不溶性固体除去,向滤液中加入H2O2,发生的离子反应方程式为2Fe2+H2O2+2H+=2Fe3++2H2O,加入Y调节溶液的pH,Y应该能和H+反应且不能引进新的杂质,可以用ZnO或ZnCO3;将Fe3+转化为Fe(OH)3沉淀,然后采用过滤方法得到Fe(OH)3沉淀,向滤液中加入过量Zn粒,发生的离子方程式为Zn+Cu2+=Cu+Zn2+,然后过滤,得到的滤渣中含有Zn和Cu,滤液中含有ZnSO4,向滤液中加入NH4HCO3,发生双水解反应生成碱式碳酸锌沉淀和硫酸铵溶液,过滤洗涤得到滤渣碱式碳酸锌;将滤渣焙烧得到活性ZnO,
(1)分离难溶性固体和溶液采用过滤方法,所以操作a为过滤;除杂时要除去杂质且不能引进新的杂质,ZnO、ZnCO3和氢离子反应生成锌离子,且不引进杂质,提高溶液的pH,从而将铁离子转化为沉淀,
故答案为:过滤;ab;
(2)过滤时,需要的玻璃仪器有漏斗、玻璃棒和烧杯,故答案为:漏斗、玻璃棒和烧杯;
(3)该流程中,滤渣R吸附的离子是硫酸根离子,用盐酸酸化的氯化钡离子检验硫酸根离子,如果最后洗涤液中加入氯化钡溶液后不产生沉淀就说明洗涤干净,
故答案为:取最后洗涤液中的上清液于试管中,然后加入氯化钡溶液,如果不产生白色沉淀就说明已经洗涤干净;
(4)Zn(OH)2在水中同时存在两种电离方式:Zn2++2 OH-?Zn(OH)2?ZnO22-+2H+,Zn(OH)2与NaOH溶液反应生成偏锌酸钠和水,离子方程式为Zn(OH)2+2OH-=ZnO22-+2H2O,
故答案为:Zn(OH)2+2OH-=ZnO22-+2H2O;
(5)n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,恰好溶解时消耗氯化氢0.08摩尔,根据关系式2HCl---Zn2+得n(Zn2+)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.08mol=0.04mol,则Zn、C原子个数之比=0.04mol:0.01mol=4:1,
要使碱式碳酸锌化合价的代数和为0,则OH-个数应该是6,碱式碳酸锌为Zn4(OH)6CO3,
水的物质的量=$\frac{4.4g-0.01mol×(65×2+17×6+60)g/mol}{18g/mol}$=0.08mol,
据此确定化学式为Zn4(OH)6CO3.8H2O,
故答案为:Zn4(OH)6CO3.8H2O.
点评 本题考查物质制备实验方案设计,为高频考点,涉及复杂化学式的确定、离子方程式的书写、基本实验操作等知识点,明确流程图中发生的反应及基本操作方法是解本题关键,难点是(5)题计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | Na2O2和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都易溶于水,相同温度下,碳酸钠的溶解度大于碳酸氢钠 | |
| B. | 水溶液都呈碱性,相同物质的量浓度时,碳酸钠溶液的pH大于碳酸氢钠溶液 | |
| C. | 碳酸钠的稳定性比碳酸氢钠强,碳酸氢钠受热易分解 | |
| D. | 碳酸钠与碳酸氢钠溶液可以用澄清石灰水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com