
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
分析 ①水分解反应是吸热反应;
②能源可划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源;需要依靠其它能源的能量间接制取的能源称为二级能源;
③氢气作燃料燃烧产物为水,温室效应与二氧化碳的排放有关;
④CO2+3H2$\frac{\underline{\;钌-膦鉻合物\;}}{加压}$CH3OH+H2O,可减少二氧化碳的排放,同时储存能源.
解答 解:①把太阳光变成激光用于分解海水制氢,太阳光提供能量,所以,水分解反应是吸热反应,故①错误;
②自然界中没有现存的氢气,把太阳光变成激光用于分解海水制氢,说明氢气为二级能源,故②错误;
③温室效应产生的原因是二氧化碳的增多,使用氢气作燃料2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,能减少二氧化碳的含量,有助于控制温室效应,故③正确;
④甲醇是重要的化工原料,也可作燃料,CO2+3H2$\frac{\underline{\;钌-膦鉻合物\;}}{加压}$CH3OH+H2O,可减少二氧化碳的排放,同时储存能源,可改善生存条件,故④正确;
故选C.
点评 本题主要考查了海水制氢,了解能源分类、温室效应抓住题干信息结合相关知识分析是解答的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应选用球形分液漏斗进行分液,使用前要检查是否漏水 | |
| B. | 将混合液倒入分液漏斗,塞紧玻璃塞,上下振荡 | |
| C. | 混合液摇匀后,立即将分液漏斗放在铁圈上静置,分层 | |
| D. | 打开分液漏斗的玻璃塞,再打开旋塞,使下层液体从分液漏斗下端放出,待下层液体完全流出后关闭旋塞,把上层液体从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
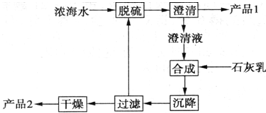 将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 风能是人类通过风车等工具获取的能源,属于一次能源 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 原电池将把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Mg2+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是氧化剂,NH4Cl是还原剂 | |
| B. | N2既是氧化产物,又是还原产物 | |
| C. | 氧化剂和还原剂的物质的量之比是1:1 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com