
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
分析 在某状态下,1mol气体所占有的体积称为该状态下的气体摩尔体积.气体摩尔体积的数值和状态有关,在标况下为Vm=22.4L/mol,且只适用于气体,据此分析.
解答 解:A、标况下Vm=22.4L/mol,即在标况下,1mol任何气体的体积均为22.4L,故A正确;
B、气体摩尔体积的数值和所处的状态有关,即1mol气体的体积不一定是22.4L,故B错误;
C、标况下1mol任何气体的体积均为22.4L,故1molO2和N2混合气(任意比)的体积约为22.4L,故C正确;
D、气体摩尔体积的数值和所处的状态有关,故数值不一定是22.4,且单位为L/mol,故D错误.
故选AC.
点评 本题考查了气体摩尔体积的数值和单位,难度不大,应注意的是气体摩尔体积的数值和所处的状态有关,状态改变,数值则改变.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
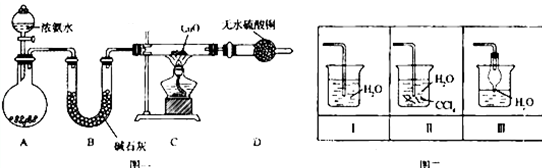
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 容器体 积/L | 平衡时O2转化率 | 平衡时 压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1>p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
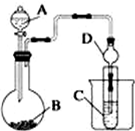 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com