
下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
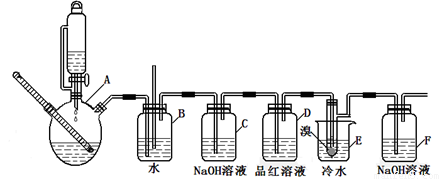
有关数据列表如下:
|
|
乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
状态 |
无色液体 |
无色液体 |
无色液体 |
|
密度/g/cm3 |
0.79 |
2.2 |
0.71 |
|
沸点/℃ |
78.5 |
132 |
34.6 |
|
熔点/℃ |
一l30 |
9 |
-1l6 |
请按要求回答下列问题:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:____________________________________________________________。
(2)气体发生装置使用连通滴液漏斗的原因_________________________________________。
(3)装置D中品红溶液的作用是_______________;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象_______________________________________。
(4)反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是_____________________________________________。
(5)判断该制备反应已经结束的方法是__________________;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是_______________________________________。
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是____________________________。
(1)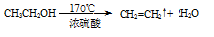 (2分)
(2分)
(2)使连通滴液漏斗里的溶液容易滴下(2分)
(3)验证二氧化硫是否被除尽;玻璃管中液面上升(2分);
(4)减少液溴挥发;1,2—二溴乙烷易凝结成固体而发生堵塞(2分)
(5)E中液体由红棕色变为无色;副反应发生或反应太剧烈(2分);
(6)是;乙烯和液溴均易溶于四氯化碳(2分)
【解析】
试题分析:(1)在加热和催化剂的作用下乙醇发生消去反应生成乙烯,然后乙烯和溴水发生加成反应生成1,2-二溴乙烷,反应的化学方程式是 。
。
(2)气体发生装置使用连通滴液漏斗,主要是兴液面上下的大气压强相同,使连通滴液漏斗里的溶液容易滴下。
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;;同时B装置是安全瓶,若E中发生堵塞,玻璃管中液面肯定会上升。
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;;但又不能过度冷却(如用冰水),其原因是1,2—二溴乙烷易凝结成固体而发生堵塞。
(5)判断该制备反应已经结束的方法是E中液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是副反应发生如生成乙醚或反应太剧烈使部分乙醇挥发。
(6)乙烯和液溴均易溶于四氯化碳,可进行充分吸收,故可行。
考点:考查1,2-二溴乙烷制备的有关实验探究。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:阅读理解
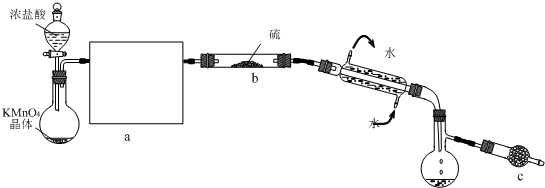

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

 TiCl4+2CO
TiCl4+2CO TiCl4+2CO
TiCl4+2CO| 编号 | 装置缺陷和不妥之处 | ① | ② | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

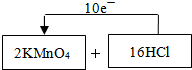

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com