
【题目】NaCN是重要的化工原料,可应用于冶金等领域,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_______________;
(2)现代开采金矿的流程如下:
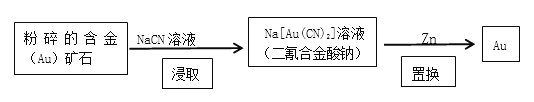
“粉碎”的目的是____________________;“浸取”反应的氧化剂是____________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式:________。
【答案】+2价 ![]() 增大接触面积,加快反应速率 O2 1∶2 Na2CO3 + C + 2NH3 =2NaCN + 3H2O
增大接触面积,加快反应速率 O2 1∶2 Na2CO3 + C + 2NH3 =2NaCN + 3H2O
【解析】
(1)在NaCN中,Na为+1价,N为-3价,根据化合物中正负化合价代数和为零,可推算出C的化合价;根据Na、C、N原子最外层电子数和NaCN属于离子化合物分析NaCN的电子式;
(2)“粉碎”的目的是增大接触面积,提高浸取速率;由NaCN、Au和Na[Au(CN)2]的化合价分析知,只有Au的化合价由0到+1价,其他化合价没有变化,这时考虑空气中的氧气参与了反应,再根据各物质得失电子数守恒分析解答;
(3)根据氧化还原的反应规律,Na2CO3中+4价的C和焦炭分子中0价的C发生归中反应,得到NaCN,再利用电子守恒法和原子守恒法来配平该方程式。
(1)在NaCN中,Na为+1价,N为-3价,则C的化合价为+2价,NaCN为离子化合物,电子式为![]() ,故答案为:+2价;
,故答案为:+2价;![]() ;
;
(2)“粉碎”的目的是增大接触面积,提高浸取速率;根据题意可知,NaCN溶液与Au以及空气中的氧气反应,得到Na[Au(CN)2](二氰合金酸钠)溶液,反应的化学方程式为:4 Au + 8NaCN + 2H2O + O2 = 4Na[Au(CN)2] +4NaOH,所以氧化剂是氧气,1mol Na[Au(CN)2]还原成1mol金得到1mol电子,1mol锌反应失去2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2,
故答案为:O2;1:2;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取NaCN,同时会生成水,Na2CO3中+4价的C和焦炭分子中0价的C发生归中反应,得到NaCN,反应的化学方程式为Na2CO3 + C + 2NH3 =2NaCN + 3H2O,故答案为:Na2CO3 + C + 2NH3 =2NaCN + 3H2O。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:

(1)该反应的化学方程式为______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为__________;
(3)平衡时容器内混合气体密度比起始时________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是_________。
2HI(g)达到平衡状态的是_________。
(2)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一事实能说明生物界与非生物界具有统一性
A. 生物与非生物都具有化学变化
B. 生物与非生物都含有碳元素
C. 组成无机自然界的化学元素在生物体内都可以找到
D. 组成生物体的化学元素在无机自然界中都可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
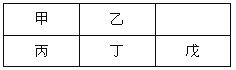
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋是重要的调味晶,我国劳动人民在很早以前就知道酒在空气中能“酸败成醋”,该事实的实质是( )
A.酒中的乙醇被氧化成乙酸
B.酒中的乙醇挥发,使乙醇的含量降低
C.酒中的杂质腐败成酸
D.酒中的乙醇被氧化成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A. | 将2.5g CuSO4·5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B. | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
D. | 分别向2支试管中加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1FeCl3溶液 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取等物质的量浓度的氢氧化钠溶液各![]() ,再通入一定量的
,再通入一定量的![]() ,随后分别各取
,随后分别各取![]() 溶液,向其中逐滴滴入
溶液,向其中逐滴滴入![]() 的盐酸,在标准状况下产生
的盐酸,在标准状况下产生![]() 的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):

(1)在A情况下,溶质是(填化学式)_____________________,其物质的量之比为______________
(2)在B情况下,溶质是(填化学式)____________________其物质的量之比为______________
(3)原氢氧化钠溶液的物质的量浓度 _____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com