
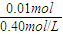 =0.025L=25mL,
=0.025L=25mL,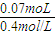 =0.175L=175mL,
=0.175L=175mL,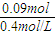 =0.225L=225mL,
=0.225L=225mL,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
某50ml溶液含0.2mol/LAl2(SO4)3和0.005molH2SO4,向此溶液中缓缓滴加0.40mol/L的NaOH溶液至生成的沉淀恰好溶解,试计算(填写计算结果,不必书写计算过程):
(1)开始沉淀时,加入NaOH溶液的体积。
(2)生成沉淀质量最大时加入的NaOH溶液的体积。
(3)沉淀完全溶解时,加入NaOH溶液的最小体积。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com