
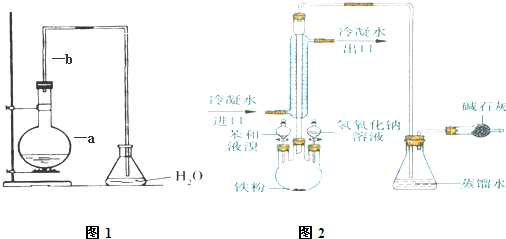
 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013届山东省莱芜市第一中学高三12月阶段性测试化学试卷 题型:填空题
榴石矿石可以看作CaO、Fe2O3、Al2O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是________。
(2)对溶液Ⅰ进行操作时,控制溶液pH=9~10 (有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致_________溶解, 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列有关实验装置的说法中正确的是
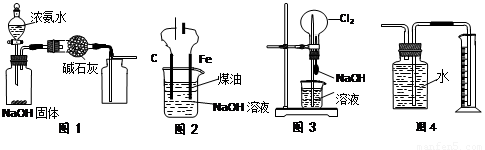
A.用图1装置制取干燥纯净的NH3
B.用图2装置实验室制备Fe(OH)2
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省莱芜市高三12月阶段性测试化学试卷 题型:填空题
榴石矿石可以看作CaO、Fe2O3、Al2O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
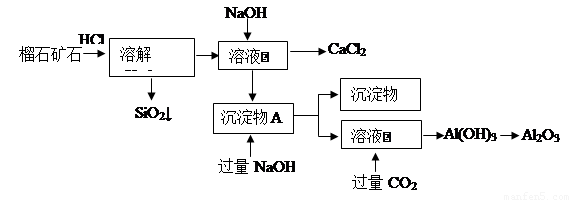
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是________。
(2)对溶液Ⅰ进行操作时,控制溶液pH=9~10 (有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致_________溶解, 沉淀。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Ca(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
12.0 |
(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
(4)①某同学在实验室中用图1装置制取CO2气体并通入溶液Ⅱ中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀,该同学对图1装置进行了改进,改进的方法为 。
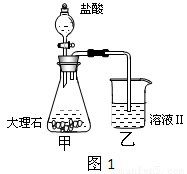
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com