
 ①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.分析 ①计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
②逆反应的反应热=正反应活化能-逆反应活化能;
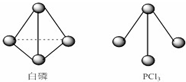
③已知白磷(P4)和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243,P-Cl 331,可写出1mol白磷完全反应生成PCl3(s)时反应的热化学方程式;
④当有4NA个电子转移时,反应的硫和氧气,生成的二氧化硫都是1mol,标注物质聚集状态和对应焓变写出热化学方程式;
⑤根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
⑥根据CO2与NaOH溶液反应,计算出CO2的物质的量,进而计算出乙醇的物质的量,根据乙醇的物质的量和热量的关系求出,可写出反应的热化学方程式.
解答 解:①0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1;
②逆反应的反应热=逆反应活化能-正反应活化能=409.0kJ/mol-167.2kJ/mol=+241.8KJ/mol-1,该反应热化学方程式为H2O(g)=H2(g)+1/2O2(g)△H=+241.8KJ/mol-1;
故答案为:H2O(g)=H2(g)+1/2O2(g)△H=+241.8KJ/mol-1;
③已知白磷(P4)和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243,P-Cl 331.则1mol白磷完全反应生成PCl3(s)时的热化学方程式为P4(s,白磷)+6Cl2(g)=4PCl3(s)△H=-1326 KJ/mol,
故答案为:P4(s,白磷)+6Cl2(g)=4PCl3(s)△H=-1326 KJ/mol;
④已知S(s)+O2(g)?SO2(g) 当有4NA个电子转移时,放出297.23kJ的热量,该反应的热化学方式为:S(s)+O2(g)?SO2(g)△H=-297.23KJ/mol;
故答案为:S(s)+O2(g)?SO2(g)△H=-297.23KJ•mol-1;
⑤1gCH4在氧气中燃烧生成CO2和液态水,放出QkJ热量,16g即1molCH4在氧气中燃烧生成CO2和液态水,放出16QkJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16QkJ•mol-1;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16Q kJ•mol-1;
⑥8mol/L的NaOH溶液50ml:n(NaOH)=0.05L×8mol/L=0.4mol,CO2与NaOH溶液反应:2NaOH+CO2═Na2CO3+H2O,则由CO2~2NaOH可知,n(CO2)=0.2mol,则n(C2H6O)=$\frac{1}{2}$×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,此反应的热化学方程式为C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-10Q kJ•mol-1.
故答案为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-10Q kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ③④⑤⑥⑦ | C. | ③⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 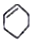 属于芳香族化合物 属于芳香族化合物 | B. | 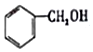 属于酚类化合物 属于酚类化合物 | ||
| C. | 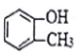 属于脂环化合物 属于脂环化合物 | D. | CH3CH2CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+)=6 mol | |
| B. | 电解后得到的Cu的物质的量为2 mol | |
| C. | 上述电解过程中共转移8 mol电子 | |
| D. | 电解后溶液中c(H+)=4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不含OH-的溶液 | B. | 使酚酞试剂呈无色的溶液 | ||
| C. | pH=7的溶液 | D. | c(H+)=$\sqrt{{K}_{w}}$的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3和KHCO3都属于盐 | B. | KOH和NH3都属于碱 | ||
| C. | H2SO4和H2S都属于酸 | D. | CaO和NO都属于氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com