
 (1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).
(1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).| 实验步骤 | 设计此步骤的目的 |
| 将配制的NaOH溶液加热 | 除去溶液中溶解的氧气 |
| 在加热后的溶液中滴加酚酞,并在上方滴加一些植物油 | 隔绝空气 |
| 实验方案 | 观察到的现象和结论 |
| 分别配制不同浓度的NaOH溶液,然后各滴加2~3滴酚酞溶液,较稀的NaOH溶液中出现红色,很浓的NaOH溶液中无红色出现(或先变红色,一会儿红色消失) | 说明红色消失与NaOH溶液的浓度有关(或:向原红色消失的溶液中慢慢加入足量的水,红色重新出现;说明红色消失与NaOH溶液的浓度有关) |
分析 (1)实验过程中需要使用的仪器除铁架台,滴定管夹外还有酸式滴定管、碱式滴定管、锥形瓶、烧杯等;
设NaOH溶液、盐酸的浓度,然后根据滴定曲线立方程式组来求解;
(2)①如果“可能是氢氧化钠溶液与空气中二氧化碳反应的缘故”,而碳酸钠溶液显碱性,也可使酚酞试剂变红;
②为排除“可能是酚酞与空气中氧气反应,使红色消失的缘故”,避免氢氧化钠溶液中出现氧气或空气,实验中“加热”目的是:赶走溶液中少量氧气,“滴入植物油”目的是:隔绝氧气;
③如果“可能与氢氧化钠溶液浓度的大小有关”,方案二:向原红色消失的溶液中加,加水稀释溶液变红,则说明红色消失与氢氧化钠溶液浓度大小有关.
解答 解:(1)实验过程中需要使用的仪器除铁架台,滴定管夹外还有酸式滴定管、碱式滴定管、锥形瓶、烧杯等,
设NaOH溶液、盐酸的浓度分别为Y mol/L,Xmol/L;
当加入15.00ml盐酸时,溶液的pH=13,则有:10mL×Y mol/L-15.00mL×Xmol/L=25.00mL×10-1mol/L;
当加入16.00ml盐酸时,溶液的pH=7,则有:16mL×Xmol/L=10mL×Ymol/L;
解得:X=2.5;Y=4,
故答案为:酸式滴定管、碱式滴定管、锥形瓶、烧杯;2.5mol/L;
(2)①如果“可能是氢氧化钠溶液与空气中二氧化碳反应的缘故”,而碳酸钠溶液显碱性,也可使酚酞试剂变红,
故答案为:NaOH溶液与CO2反应生成的Na2CO3溶液也呈碱性,遇酚酞也会变红色;
②实验中“加热”目的是:赶走溶液中少量氧气,避免氢氧化钠溶液中出现氧气或空气,
在加热后的溶液中滴加酚酞,并在上方滴加一些植物油,可隔绝空气,
故答案为:除去溶液中溶解的氧气; 隔绝空气;
③若丙同学的猜想正确,则分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液,浓度大的溶液中酚酞红色会消失,则证明红色消失与氢氧化钠溶液的浓度大小有关,或向原红色消失的溶液中加水,红色重新出现,则说明红色消失与氢氧化钠溶液浓度大小有关,
故答案为:分别配制不同浓度的NaOH溶液,然后各滴加2~3滴酚酞溶液,较稀的NaOH溶液中出现红色,很浓的NaOH溶液中无红色出现(或先变红色,一会儿红色消失);说明红色消失与NaOH溶液的浓度有关(或:向原红色消失的溶液中慢慢加入足量的水,红色重新出现;说明红色消失与NaOH溶液的浓度有关).
点评 本题考查了如何探究物质的性质和变化规律,侧重于学生的分析、实验能力的考查,掌握反应现象与本质的联系、学会猜想和事实验证的方法是解题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 平行实验编号 | Na2C2O4溶液 (mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
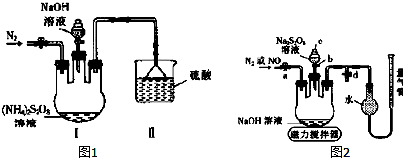
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
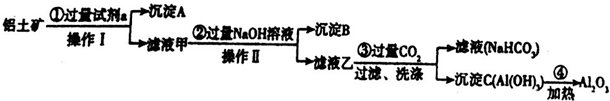
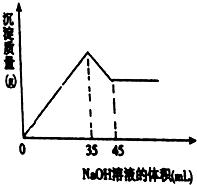
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
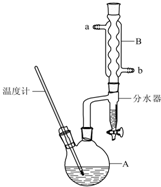 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/g•cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com