
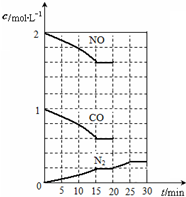
 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、若混合溶液的pH>7,则一定有c1?V1≥c2?V2 |
| B、若V1=V2,c1=c2,则混合液中c(NH+4)>c(Cl-) |
| C、若混合液的 pH=7,则混合液中c(NH4+)=c(Cl-) |
| D、若V1=V2,且混合液的pH<7,则一定有c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
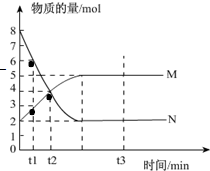 I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
| B、2 g氢气所含原子数目为NA |
| C、标准状况下,1.12L16O2和1.12L18O2均含有0.05NA个氧原子 |
| D、17 g氨气所含电子数目为10 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com