
(1)56号元素位于第________周期________族。
(2)114号元素位于第________周期________族。
(3)25号元素位于第________周期________族。
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的划“√”,错误的划“×”
(1)氢键是氢元素与其他元素形成的化学键( )
(2)可燃冰(CH4·8H2O)中甲烷分子与水分子间形成了氢键( )
(3)乙醇分子和水分子间只存在范德华力( )
(4)碘化氢的沸点高于氯化氢的沸点是因为碘化氢分子间存在氢键( )
(5)水分子间既存在范德华力,又存在氢键( )
(6)氢键具有方向性和饱和性( )
(7)H2和O2之间存在氢键( )
(8)H2O2分子间存在氢键( )
(9)卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大( )
(10)氢键的存在一定能使物质的熔、沸点升高( )
(11)极性分子中可能含有非极性键( )
(12)H2O比H2S稳定是因为水分子间存在氢键( )
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O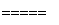 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
请回答下列问题:
(1)高铁电池的负极材料是________。
(2)放电时,正极发生________(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-===Zn(OH)2,则正极反应为__________________________________________________。
(3)放电时,________(填“正”或“负”)极附近溶液的碱性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为 ( )
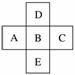
A.5x+10 B.5x
C.5x+14 D.5x+16
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是三种主族元素,如果Xn+阳离子与Yn-阴离子具有相同的电子层结构,Zn-阴离子半径大于Yn-阴离子半径,则三种元素的原子序数由大到小的顺序是( )
A.Z>X>Y B.X>Y>Z
C.Z>Y>X D.X>Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
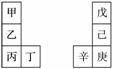
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差11
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________________________________________________________________
与盐酸反应最剧烈,________________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________________________________________________________________________
________________________________________________________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
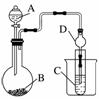
(3)仪器A的名称为______,干燥管D的作用是________________________________________________________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________________________________________________________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
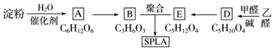
已知:SPLA的结构为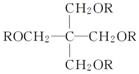 ,其中R为
,其中R为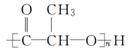
(1)淀粉是____糖(填“单”或“多”);A的名称是______。
(2)乙醛由不饱和烃制备的方法之一是_________________________________________
______________________________________________(用化学方程式表示,可多步)。
(3)D—→E的化学反应类型属于________反应;D结构中有3个相同的基团,且1 mol D能与2 mol Ag(NH3)2OH反应,则D的结构简式是________;D与银氨溶液反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2悬浊液反应,且1 mol G与足量Na反应生成1 mol H2,则G的结构简式为________________________________________________________________________。
(5)B有多种脱水产物,其中两种产物的结构简式为____________和____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com