
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中 含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是:__________________________________。
(3)步骤③中反应的离子方程式是:_________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______ _、灼烧、________、称量。
_、灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
解析 (1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸等),若滤液由浅绿色变为红色,则说明滤液中含有Fe2+。
(2)由于H2O2具有氧化性,加入过量H2O2的目的是:将Fe2+全部氧化为Fe3+。
(3)步骤③的目的是:将Fe3+全部转化为Fe(OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-===Fe(OH)3↓[或Fe3++3NH3·H2O===Fe(OH)3↓+3NH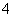 ]。
]。
(4)步骤④的目的是:将产生的红褐色悬浊液分离,最终得到固体Fe2O3,所以步骤④的操作步骤是:过滤、洗涤,灼烧、冷却、称量。
(5)由于实验中铁无损耗,根据铁元素守恒得,每片补血剂中m(Fe)=(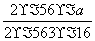 ÷10)g=0.07a g。
÷10)g=0.07a g。
答案 (1)氯水(或双氧水、稀硝酸等合理氧化剂) 溶液由浅绿色变为红色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-===Fe(OH)3↓
[或Fe3++3NH3·H2O===Fe(OH)3↓+3NH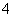 ]
]
(4)洗涤 冷却 (5)0.07 a


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
A.将混合气体通过盛有酸性高锰酸钾溶液的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色;
②苯环中的碳碳键的键长均相等;
③苯能在一定条件下跟H2加成生成环己烷;
④苯在FeBr3存在的条件下与液溴可发生取代反应,但不因化学变化而使溴水褪色。
A.②③④ B.①③④ C.①②④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
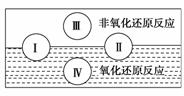
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
________________________________________________________________________其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl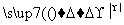
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________ (填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10,
10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.Fe在一定条件下与水反应生成H2和Fe(OH)3
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色
C.FeCl2溶液蒸干灼烧后得到FeCl2固体
D.将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
能证明碳酸比硅酸酸性强的实验事实是( )
|
B.高温下能反应 Na2CO3+SiO2====Na2SiO3+CO2↑
C.CO2溶于水生成碳酸,而SiO2却不溶于水
D.CO2通入Na2SiO3溶液中有胶状沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3,SiO2),提取冶炼铝的原料氧化铝。提取的操作过程如下:
工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3,SiO2),提取冶炼铝的原料氧化铝。提取的操作过程如下:
已知: 2NaAlO2+4H2SO4(过量)=Al2 (SO4)3 + Na2SO4 +4H2O
(1). 实验室完成步骤①—③都有的实验操作为 ,该实验操作所需要的玻璃仪器除烧杯外还需要 ;
(2). 步骤①反应的化学方程式是:
(3). 步骤①后所得残渣主要成分为: (填化学式);滤液1中要加入过量稀硫酸,所得沉淀的是_____________(填化学式)。
(4).步骤③通入NH3后得到Al(OH)3的离子方程式是: 。
(5).步骤④反应的化学方程式是:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将amol·L-1 的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
A.若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com