
分析 (1)根据6FeC2O4+3H2O2+6K2C2O4═4K3[Fe(C2O4)3]+2Fe(OH)3中K3[Fe(C2O4)3]的量,求H2O2的物质的量;
(2)由草酸可作还原剂,H2O2作氧化剂,并根据元素守恒书写方程式;
(3)根据Fe元素守恒计算25mL溶液中n(Fe3+),进而计算9.82g草酸合铁酸钾晶体中n(Fe3+),再根据电荷守恒计算n(K+),晶体中m(H2O)=9.82g-m(K+)-m(Fe3+)-m(C2O42-),进而计算n(H2O),从而确定其化学式.
解答 解:(1)6FeC2O4+3H2O2+6K2C2O4═4K3[Fe(C2O4)3]+2Fe(OH)3
3 4
0.75 1
故答案为:0.75mol;
(2)草酸可作还原剂,H2O2作氧化剂,由元素、电子守恒可知方程式为H2C2O4+H2O2=2CO2↑+2H2O,
故答案为:H2C2O4+H2O2=2CO2↑+2H2O;
(3)消耗KMnO4的物质的量为0.1000mol/L×0.024L=0.0024mol
依据化学方程式:5C2O42-+2MnO4-+16H+=2Mn2++8H2O+10CO2↑
5 2
0.006 0.0024
可知:n(C2O42-)=0.006mol.
250mL原溶液中C2O42-的物质的量为0.006mol×10=0.06mol
则n[K3Fe(C2O4)3]=0.06mol×$\frac{1}{3}$=0.02mol.m[K3Fe(C2O4)3]=n[K3Fe(C2O4)3]M=0.02×437=8.74g
m(H2O)=9.82-8.74=2.28=1.08g
n(H2O)=$\frac{1.08}{18}$=0.06ml,
即0.02x=0.06,故x=3,
答:该晶体的化学式为K3[Fe(C2O4)3•3H2O].
点评 本题考查物质组成的测定、化学计算,侧重考查学生分析计算能力,需要学生具备扎实的基础,关键是确定各离子物质的量关系,难度稍大.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与足量Ca(OH)2的反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO${\;}_{{3}_{\;}^{\;}}^{2-}$+2H2O | |
| B. | 少量Na投入冷水中;Na+2H2O═Na++OH-+H2↑ | |
| C. | CuSO4与Ba(OH)2的反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ | |
| D. | AlCl3溶液中加入足量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素均为非金属元素 | |
| B. | W与X、Y形成的最简单分子的沸点:X>Y | |
| C. | Y、Z形成的化合物中只含离子键 | |
| D. | W、Y、Z形成的化合物的电子式为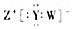 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g | B. | 5.6 g | C. | 11.2 g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 用50 mL 0.55 mol•L-1的NaOH溶液与60 mL 0.50 mol•L-1的盐酸反应,测得的中和热数值偏大 | |
| D. | 使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com