
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1, 则可知 C 的热值为 110.5 kJ·mol1
C. 0℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
【答案】D
【解析】
A.酸碱中和是放热反应,故△H应为负值,故A错误;
B.燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,定义要点:必须完全燃烧生成稳定的氧化物,如C→CO2,H→H2O(液),而2C(s)+O2(g)=2CO(g)△H=-221kJmol-1,是碳的不完全燃烧,故B错误;
C.N2(g)+3H2(g)2NH3(g),该反应是可逆反应,所以△H>38.6kJmol-1,故C错误;
D.则根据方程式Fe+S=FeS可知,反应中硫是过量的,则1mol参加反应放出的热量是19.12 kJ×1mol/0.2mol=95.6kJ,因此该反应的热化学方程式为Fe(s)+S(s)=FeS(s) △H=-95.6kJ/mol,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa, 25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20 mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是( )
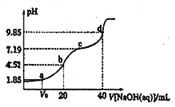
A. a点所得溶液中:c(H2A)>c(HA-) B. b点所得溶液中:c(H2A)+(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-) D. d点所得溶液中A2-水解平衡常数Kh1=10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:
干海带![]() 海带灰
海带灰![]() 水溶液
水溶液![]()
![]()
![]() ―→碘单质
―→碘单质
下列有关叙述正确的是( )
A. 碘元素在海水中也有游离态存在 B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶 D. B是提纯操作,常用蒸馏或分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. BF3和NH3的空间构型都为平面三角形
B. 晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI
C. 熔点:Na-K合金<氯化钠<钠<金刚石
D. 空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是合成草酸铁的重要原料。
利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

(1)抑制FeCl3水解,溶液X为___________。
(2)流程中FeCl3能被异丙醚萃取,其原因是__________________________;检验萃取、分液后所得水层中是否含有Fe3+的方法是_______________________________________。
(3)得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是________________________。
(4)为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_____(填“甲”或“乙”)中。
![]()
下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是_____________。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:
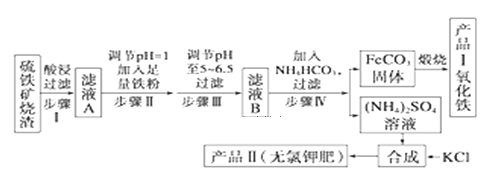
回答下列问题:
(1))古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________(填字母) a.Fe b.FeO c.Fe2O3 d.Fe3O4
(2)酸浸、过滤后滤液A中的金属阳离子是_________,检验其中较低价态的阳离子所用试剂为________(填化学式)。煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为_______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 _____、趁热过滤、洗涤、干燥.
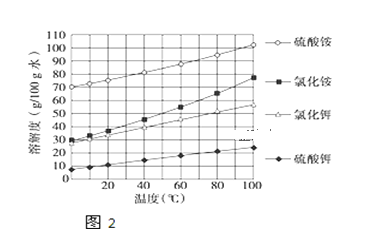
(4)进一步提纯产品Ⅱ的方法是;__________________
(5)步骤IV反应的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
A. v正(B)=2v逆(C) B. 每消耗1molC,同时生成1molD
C. 气体的密度保持不变 D. 容器内压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
A.FeCl3溶液(FeCl2):通入适量Cl2
B.Fe2O3固体(Al2O3):加入烧碱溶液,过滤
C.CO2气体(HCl):通过Na2CO3溶液洗气后干燥
D.Na2CO3固体(NaHCO3):加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com