
| A. | 常温常压下,8.8 g CO2和N2O混合气体中所含的电子数为4.4 NA | |
| B. | 6.72 L NO2与水充分反应转移的电子数目为0.2 NA | |
| C. | 1.0 L 1.0 mol/L的NaAlO2水溶液中含有的氧原子数为2 NA | |
| D. | 64 g加热了的铜丝在硫磺蒸气里完全反应后,失去的电子数为2 NA |
分析 A、CO2和N2O的摩尔质量均为44g/mol,且均含22个电子;
B、二氧化氮气体所处的状态不明确;
C、偏铝酸钠溶液中,除了偏铝酸钠外,水也含O原子;
D、求出铜的物质的量,然后根据铜和硫反应后变为+1价来分析.
解答 解:A、CO2和N2O的摩尔质量均为44g/mol,故8.8g混合物的物质的量为0.2mol,且两者均含22个电子,故0.2mol混合物中含有4.4NA个电子,故A正确;
B、二氧化氮气体所处的状态不明确,故其物质的量无法计算,故B错误;
C、偏铝酸钠溶液中,除了偏铝酸钠外,水也含O原子,故溶液中含有的氧原子的个数多于2NA个,故C错误;
D、64g铜的物质的量为1mol,而铜和硫反应后变为+1价,故1mol铜失去NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 原溶液中一定不存在Ag+、Al3+、Ba2+、SO42- | |
| B. | 实验中生成沉淀的离子方程式是SiO32-+2H+=H2SiO3↓ | |
| C. | 原溶液一定存在K+、CO32-,可能存在NO3- | |
| D. | 原溶液不存在NO3-时,c(K+)=0.8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将78g Na2O2与过量CO2反应转移的电子数为2NA | |
| B. | 1molN2与4mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4中所含原子数为0.5NA | |
| D. | 标准状况下,18gD2O中所含电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向新制的氯水中加入NaHCO3粉末,有气泡产生,说明氯元素的非金属性强于碳 | |
| B. | 向Fe(NO3)3溶液中通入适量SO2气体后,再滴加BaCl2溶液,产生白色沉淀,说明Fe3+能够将H2SO3氧化为H2SO4 | |
| C. | 向NaOH溶液中滴加少量的MgCl2溶液,产生白色沉淀,然后再滴加足量的CuCl2溶液,沉淀变蓝色,说明 Ksp[Cu(OH)2]<Ksp[Mg(OH)2] | |
| D. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈紫色,说明该溶液一定含有钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能热水器,太阳能电池、由玉米制乙醉部涉及生物质能的利用 | |
| B. | “地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油 | |
| C. | 以淀粉浓液作指示剂,用已知浓度的碘溶液来测定食品中SO2的残留量 | |
| D. | 雾霾属于分散系,减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
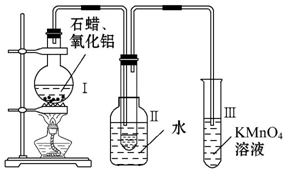 某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | N的一种氧化物可用作油漆和涂料 | |
| C. | 热稳定性:XM>X2Z | |
| D. | X2Z、WM4分子中各原子最外层均为8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com