


科目:高中化学 来源: 题型:
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、Na+、HCO3-、NO3- |
| C、Ba2+、Na+、OH-、Cl- |
| D、OH-、SO32-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al→Al3++3e- |
| B、由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al+4OH→-Al(OH)4-+3e- |
| C、由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu→Cu2++2e- |
| D、由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu→Cu2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-) |
| B、c(NH4+)<c(Cl-) |
| C、c(NH4+)=c(Cl-) |
| D、不能确定c(NH4+)与c(Cl-)的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
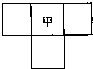 甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.
甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO4和KClO3 |
| B、KClO和KCl |
| C、NaClO和NaCl |
| D、NaCl和KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com