
分析 (1)由于题中强调足量的草酸,故反应后草酸转化为HC2O4-,若写成C2O42-是错误的;
(2)发现其溶液的紫红色褪去,显然说明草酸具有还原性,把MnO4-还原为Mn2+,根据氧化还原反应得失电子守恒配平反应方程式;
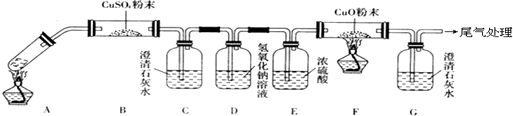
(3)检验二氧化碳可以用石灰水,除去二氧化碳可以用氢氧化钠溶液;乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成;
(4)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,结合守恒关系可得离子浓度间的大小关系.
解答 解:(1)题中强调足量的草酸,故反应后草酸转化为HC2O4-,且酸性强于碳酸,反应的离子方程式为HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)①向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4-还原为Mn2+,②反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:还原性;2;5;6;2;10;8;
(3)根据题意知乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,
故答案为:除去混合气体中的CO2;H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑;
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,两者正好1:1反应生成NaHC2O4;
A.电荷不守恒,正确的应为:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;
B.物料不守恒,正确的应为:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.2mol•L-1,故B错误;
C.溶液显酸性说明HC2O4-的电离程度大于其水解程度(程度都较小),则有c(HC2O4-)>c(C2O42-)>c(H2C2O4)故C正确;
D.根据物料守恒可知c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确;
故选CD.
点评 本题考查已二酸的分解以及溶液离子浓度的大小比较,题目较为综合,难度中等,做题时注意抓住反应的现象,以此推断物质可能具有的性质.


科目:高中化学 来源: 题型:选择题
| A. | 体积相等,密度相等的CO和C2H4 | B. | 温度相同,体积相同的O2和N2 | ||
| C. | 质量相等,密度不等的N2和CO | D. | 压强相同、体积相同的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 虚线代表的是使用了催化剂的反应的图象,该反应是吸热反应 | |
| B. | E1、E2是该反应在不同条件下的活化能,E4、E5是反应在不同条件下放出的能量 | |
| C. | 两种条件下反应的热效应相同,且虚线代表的反应速率较快 | |
| D. | 该反应的△H=E1-E5=E2-E4=E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 体积不变充入N2使压强增大 | B. | 体积不变充入O2使压强增大 | ||
| C. | 使体积增大到原来的2倍 | D. | 体积不变充入氦气使压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 向酒精和水的混合溶液中加入金属钠 | 确定酒精中混有水 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com