
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 溶解固体时烧杯在使用前必须干燥 | |
| C. | 萃取、分液前需对分液漏斗检漏,分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸馏操作时,不可以用温度计搅拌,温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
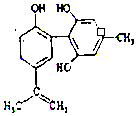
| A. | 标准状况下,22.4L HF中含有氟原子数目为NA | |
| B. | 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) | |
| C. | 1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023 | |
| B. | 标准状况下,22.4 L乙醇的共价键数为8×6.02×1023 | |
| C. | 标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023 | |
| D. | 100 mL 1 mol•L-1醋酸溶液中,H+的个数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钠溶液中通入过量CO2:OH-+CO2=HCO3- | |
| D. | FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
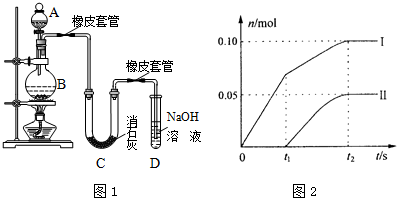
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
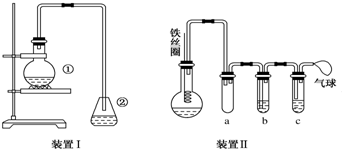
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时不能发生的过程都是非自发过程 | |
| B. | 体系的无序性越高,即混乱度越高,熵值就越大 | |
| C. | 所有自发进行的化学反应都是放热反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com