
【题目】下图中A、B、C、D分别为AlCl3、NaOH、NH4HSO4、Na2CO3溶液,实验过程和记录如下图所示(无关物质已经略去):
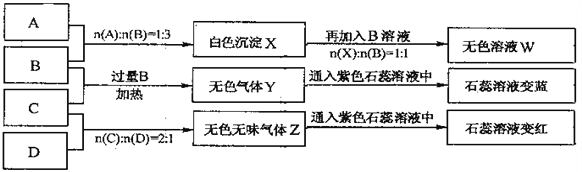
请回答:
(1)W的溶液加热蒸干并灼烧最后所得固体为__________。
(2)D溶液pH___(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)_______。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是_________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者_____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是____。
【答案】 NaAlO2 大于 CO32-+H2O![]() HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)> c (SO42-)> c (NH4+)> c (H+) =C(OH-)
HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)> c (SO42-)> c (NH4+)> c (H+) =C(OH-)
【解析】本题考查盐类水解、离子浓度大小顺序,A和B按1:3混合,发生Al3++3OH-=Al(OH)3↓,即X为氢氧化铝沉淀,再加入B溶液,按1:1混合,发生Al(OH)3+OH-=AlO2-+2H2O,即W的溶液为NaAlO2,B和C,B过量且加热,发生NH4++OH-![]() NH3↑+H2O,C和D按2:1混合,发生2H++CO32-=CO2↑+H2O,即Z为CO2,(1)根据上述分析,W为NaAlO2,AlO2-+2H2O
NH3↑+H2O,C和D按2:1混合,发生2H++CO32-=CO2↑+H2O,即Z为CO2,(1)根据上述分析,W为NaAlO2,AlO2-+2H2O![]() Al(OH)3+OH-,盐类水解属于吸热反应,升高温度,促进水解,但NaOH属于难挥发性碱,因此加热蒸干并灼烧最后得到固体是NaAlO2;(2)D为Na2CO3,碳酸钠属于强碱弱酸盐,CO32-发生水解,存在CO32-+H2O
Al(OH)3+OH-,盐类水解属于吸热反应,升高温度,促进水解,但NaOH属于难挥发性碱,因此加热蒸干并灼烧最后得到固体是NaAlO2;(2)D为Na2CO3,碳酸钠属于强碱弱酸盐,CO32-发生水解,存在CO32-+H2O![]() HCO3-+OH-,造成溶液中c(OH-)>c(H+),溶液显碱性,即pH>7;(3)AlCl3、NH4HSO4溶液显酸性,AlCl3溶液显碱性是因为是Al3+水解造成,NH4HSO4溶液显酸性,发生NH4HSO4=NH4++H++SO42-,相同浓度时,NH4HSO4中c(H+)大于AlCl3溶液中c(H+),即pH大小顺序是c(NH4HSO4)<c(AlCl3),NaOH、Na2CO3溶液显碱性,NaOH是强碱,Na2CO3是强碱弱酸盐,CO32-水解造成溶液显碱性,即pH大小是c(NaOH)>c(Na2CO3),因此pH由大到小顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;(4)NH4Cl溶液中存在:NH4++H2O
HCO3-+OH-,造成溶液中c(OH-)>c(H+),溶液显碱性,即pH>7;(3)AlCl3、NH4HSO4溶液显酸性,AlCl3溶液显碱性是因为是Al3+水解造成,NH4HSO4溶液显酸性,发生NH4HSO4=NH4++H++SO42-,相同浓度时,NH4HSO4中c(H+)大于AlCl3溶液中c(H+),即pH大小顺序是c(NH4HSO4)<c(AlCl3),NaOH、Na2CO3溶液显碱性,NaOH是强碱,Na2CO3是强碱弱酸盐,CO32-水解造成溶液显碱性,即pH大小是c(NaOH)>c(Na2CO3),因此pH由大到小顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;(4)NH4Cl溶液中存在:NH4++H2O ![]() NH3·H2O+H+,NH4HSO4相当于在NH4Cl溶液中加入H+,抑制NH4+水解,因此NH4HSO4溶液中c(NH4+)大于NH4Cl溶液中c(NH4+);(5)NaOH和NH4HSO4混合,OH-先中和HSO4-中H+,当两者恰好完全反应,溶质为Na2SO4和(NH4)2SO4,溶液显酸性,根据题意,溶液为中性,因此继续滴加NaOH,发生NH4++OH=NH3·H2O,当pH=7时,溶质为Na2SO4、(NH4)2SO4、NH3·H2O,因此离子浓度大小顺序是:c(Na+)> c (SO42-)> c (NH4+)> c (H+) =c(OH-)。
NH3·H2O+H+,NH4HSO4相当于在NH4Cl溶液中加入H+,抑制NH4+水解,因此NH4HSO4溶液中c(NH4+)大于NH4Cl溶液中c(NH4+);(5)NaOH和NH4HSO4混合,OH-先中和HSO4-中H+,当两者恰好完全反应,溶质为Na2SO4和(NH4)2SO4,溶液显酸性,根据题意,溶液为中性,因此继续滴加NaOH,发生NH4++OH=NH3·H2O,当pH=7时,溶质为Na2SO4、(NH4)2SO4、NH3·H2O,因此离子浓度大小顺序是:c(Na+)> c (SO42-)> c (NH4+)> c (H+) =c(OH-)。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的用途说法不正确的是
A. 液氨常用作制冷剂 B. 磁性氧化铁可用作红色油漆和涂料
C. 硫酸常用于金属加工前的酸洗 D. 氧化铝可用于制造耐高温实验材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3 . (要求有解题过程)
(1)该盐酸的质量分数是多少?
(2)取这种盐酸100.00mL,稀释到500.00mL,所得的稀盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18gcm﹣3 , 其中镁离子的质量分数为5.1%,则300mL该溶液中Cl﹣的物质的量约等于( )
A.0.37 mol
B.0.63 mol
C.0.74 mol
D.1.50 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多酶片中含有蛋白酶、淀粉酶和脂肪酶,具有辅助消化的作用.其片剂是糖衣片,这样制作的目的是( )
A. 补充体内糖类物质的供给
B. 防止胃液的消化
C. 经唾液消化后即可迅速起作用
D. 使其中各种酶缓慢的起作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中碳元素的化合价+2价,N元素显-3价,则非金属性N__________C(填<,=或 >),用离子方程式表示NaCN溶液呈强碱性的原因:____________________。
(2)己知:
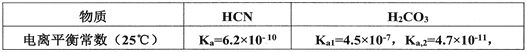
则向NaCN溶液通入少量CO2反应的离子方程式:____________________
(3)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
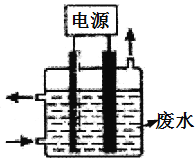
A.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
B.用石墨作阳极,铁作阴极
C.阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________________;
(5)化合物(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与NaOH溶液反应的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是硫酸
B. 反应①过滤后所得沉淀1为氧化铁
C. 图中所示转化中:Al2O3→Al可选用热分解法
D. 反应②的离子方程式为2AlO2 - + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com