
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
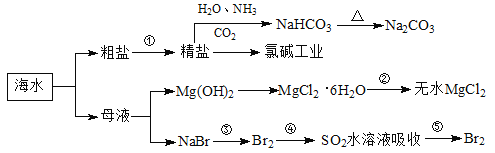
A. 制取NaHCO3的反应是利用其溶解度小于NaCl
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
【答案】A
【解析】试题分析:A.往精盐溶液中通氨气,得碳酸氢钠沉淀,说明碳酸氢钠的溶解度小于氯化钠,故A正确;B.分别向碳酸钠和碳酸氢钠溶液中加入澄清石灰水,发生Na2CO3+Ca(OH)2=2NaOH+CaCO3↓、2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+2H2O,均有白色沉淀产生,不能鉴别,故B错误;C.在工段③、④、⑤中,第④步中,SO2+2H2O+Br2=H2SO4+2HBr中S元素的化合价升高,则二氧化硫被氧化,溴元素被还原,故C错误;D.电解饱和MgCl2溶液,只能得到氢氧化镁沉淀,工业上采用电解熔融氯化镁的方法制取金属镁,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表如示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
容器的体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A. 甲中反应的平衡常数小于乙 B. 该温度下,该反应的平衡常数K为400
C. SO2的平衡转化率:α1>α2=α3 D. 容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②太阳能 ③核能 ④石油 ⑤煤 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ②⑥⑦⑧
C. ①③⑤⑥⑦⑧ D. ②③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A. 含有食品添加剂的食物对人体健康均有害
B. 玻璃和氮化硅陶瓷都属于新型无机非金属材料
C. 侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
D. “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是
A. Ca(OH)2 B. CaCO3 C. K2CO3 D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. O2与O3互称同位素
B. 铅蓄电池充电时负极连接外电源正极
C. 高纯度硅常用于制作现代通讯的光导纤维
D. 常用丁达尔效应鉴别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的叙述正确的是 ( )
A. 等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B. pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
C. pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
D. 将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. 只有活泼金属与活泼非金属之间才能形成离子键
B. 具有共价键的化合物是共价化合物
C. 化学键是分子中多个原子之间强烈的相互作用
D. 具有离子键的化合物是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com