
分析 将pH=11的NaOH溶液a L与pH=1的硫酸b L混合,
①若所得混合溶液为中性,则根据n(H+)=n(OH-)来计算;
②若所得混合溶液的pH=2,酸过量,计算出c(OH-)与酸碱的物质的量的关系,可计算.
解答 解:①将pH=11的NaOH溶液Va L与pH=1的硫酸b L混合,①若所得混合液呈中性,则n(H+)=n(OH-),所以0.1a=0.1b,所以a:b=1:1,故答案为:1:1;
②若所得混合液pH=2,则酸过量,得到$\frac{0.1b-0.1a}{a+b}$=0.01,解得a:b=9:11,故答案为:9:11.
点评 本题考查酸碱混合的计算,明确该温度下的Kw及pH与浓度的换算是解答本题的关键,注意酸碱反应的实质即可解答,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH碱溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 0.1mol•L-1Na2SO3溶液:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合溶液:$\frac{c{(HCO}_{3}^{-})}{c({H}_{2}C{O}_{3})}>$$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(CL-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨是指pH<5.6的雨水 | |
| B. | 二氧化碳大量排放会造成温室效应 | |
| C. | 白色污染会造成“水华”和“赤潮” | |
| D. | 燃煤中掺入生石灰能有效减少SO2的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
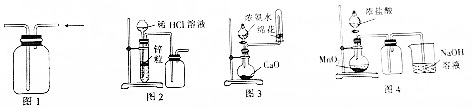
| A. | 用图1所示装置收集CO和NO | B. | 用图2所示装置制取少量氢气 | ||
| C. | 用图3所示装置制取少量氨气 | D. | 用图4所示装置制取少量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1mol绿原酸最多与7mol NaOH反应 | |
| C. | 绿原酸是芳香族化合物 | |
| D. | 绿原酸分子中有4种化学环境不同的氢原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com