
| A. | 冰的密度比液态水的密度小是因为冰分子之间含有较强的化学键 | |
| B. | 氨分子的键角比甲烷分子的键角小是因为两个分子中中心原子的杂化方式不同 | |
| C. | HF的沸点比HCl的沸点高是因为HF分子内含有氢键 | |
| D. | HF比HCl稳定是因为HF分子中共价键的键能大 |
分析 A、氢键不是化学键;
B、NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′;
C、HF的沸点比HCl的沸点高是因为HF分子间含有氢键;
D、中心元素非金属性越强氢化物越稳定,分子中共价键的键能大.
解答 解:A、冰的密度比液态水的密度小是因为冰分子之间含氢键,氢键不是化学键,故A错误;
B、NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,两个分子中中心原子的杂化方式相同,故B错误;
C、HF的沸点比HCl的沸点高是因为HF分子间含有氢键,而不是分子内氢键,故C错误;
D、因为非金属性F>Cl,而中心元素非金属性越强氢化物越稳定,所以HF比HCl稳,分子中共价键的键能大,故D正确;
故选D.
点评 本题考查了氢键、分子空间构型和化学键中共价键的强弱的判断,难度中等,注意理解价层电子对互斥理论与杂化轨道理论.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A | 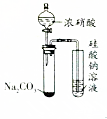 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| B | 向稀硝酸和稀硫酸中分别加入铁粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)3溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向盛有Fe(NO3)3溶液的试管中加入0.1mol•LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)>c(CH3COO-)+c(OH-) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
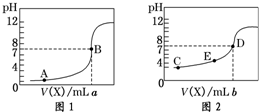 常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:
常温下,用 0.10mol•L-1NaOH 溶液分别滴定20.00mL 0.10mol•L-1 HCl溶液和20.00mL 0.10mol•L-1CH3COOH溶液,得到2条滴定曲线,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有碳碳三键的脂肪烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠可用作调味剂 | |
| B. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾可用作净水剂 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
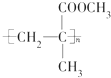 .下列关于它的叙述中不正确的是( )
.下列关于它的叙述中不正确的是( )| A. | 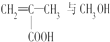 在一定条件下发生缩聚反应即可合成该有机玻璃 在一定条件下发生缩聚反应即可合成该有机玻璃 | |
| B. | 该有机玻璃能发生氧化反应 | |
| C. | 合成该有机玻璃的原料可能有甲烷 | |
| D. | 它在一定条件下发生水解反应时C-O键断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com