
【题目】(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
① CH3CH=CHCH 3 __________;
② ![]() ___________;
___________;
③ ![]() __________;
__________;
④ ![]() _____________;
_____________;
(2)按系统命名法命名
①CH3 CH(C2H5)CH(CH3)2 的名称___________________
②(CH3)2C=C(CH3)2 的名称______________________________
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于目前常用元素周期表的说法中正确的是( )
A.第ⅢB族元素种类最多
B.只有第3列到第12列全部是金属元素
C.周期数大于或等于族的序数时,一定是金属元素
D.是按原子的质量数由小到大的顺序编制的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能用于证明二者存在较大差异性的是( ) ①CO2 ②盐酸 ③NaOH溶液 ④水.
A.①④
B.②③
C.①③
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3·H2O吸收。
已知2NH3·H2O (aq) + H2SO4(aq)==(NH4)2SO4(aq)+ 2H2O(l) △H=-24.2kJ/mol,中和热△H=-57.3 kJ/mol则1mol NH3·H2O理论上完全电离时需要吸收的热量为________。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式_______。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4mol SO2,发生SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。

①a、c两点反应速率大小关系: v(a) ___v(c)。(填“>”、“<” 或“=”)
②温度为T2时从反应开始经过2min 达到b点,用SO3表示这段时间的反应速率为______,此温度下该反应的平衡常数为_______。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率_______(填“增大”、“减小”或“不变”).
③NO2的转化率随温度升高先增大后减小的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A数值为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为__________________
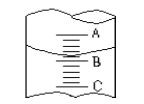
A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2ml D.①4.8mL、②小于4.8mL
②实验室需配制1mol·L-1的NaOH溶液220mL,在用托盘天平称取NaOH固体时,天平读数为________填代号,下同)。
A.大于8.8g B.小于8.8g C.8.8g
(2)表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
Ⅰ.用10%(密度为1.01g·cm3-)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需_________g10%(密度为1.01g·cm3-)的氢氧化钠溶液
②量取:用量筒量取10%的氢氧化钠溶液_________mL
Ⅱ.把98%(密度为1.84g·cm3-)的浓硫酸稀释成2mol/L的稀硫酸100ml,回答下列问题:
①需要量取浓硫酸_______ mL
②下列实验操作使配制的溶液浓度偏低的是__________
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液 , 根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-;HA-![]() H++A2-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和丙二酸等物质合成I,合成路线如下:
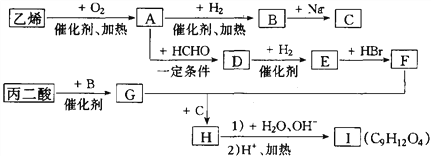
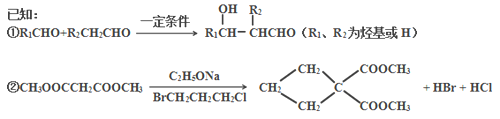
请回答下列问题:
(1)丙二酸的结构简式是_________。
(2)有机物D的分子式为C5H10O4,其官能团的名称是__________。
(3)写出A→B的化学反应方程式______________________________________。
(4)E→F的反应类型是______________。
(5)在一定条件下,丙二酸与乙二醇通过发生缩聚反应生成高分子化合物。写出该高分子化合物的化学式______________。
(6)I的同分异构体中属于芳香族化合物且满足下列条件的有_____种。
①苯环上有4个取代基;②与FeCl3溶液发生显色反应;③每种同分异构体1 mol能与1 mol碳酸钠发生反应,也能与足量金属钠反应生成2molH2;④一个碳原子连接2个或2个以上羟基不稳定。
其中苯环上的一氯代物只有一种的是___________________。(写出其中一种的结构简式)
(7)丙二酸可由乙烯、甲醛为原料制得(其它无机试剂任选)。请模仿并画出合成路线图。___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com