
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。
①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+
(1)AB段铁元素以__________形式存在。
(2)BC段铁元素以__________形式存在。
(3)CD段铁元素以__________形式存在。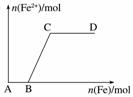
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为1.12 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
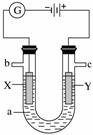
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是___________________________________________,
在X极附近观察到的现象是__________________________________________。
②Y电极上的电极反应式是__________________________________________________,
检验该电极反应产物的方法是_________________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_____________________________________________,
电极反应式是______________________________________。
②Y电极的材料是__________________________________________________,
电极反应式是________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重________________________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
锗(Ge)是第四周期第 ⅣA 元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
A.锗是一种金属性很强的元素 B.锗的单质具有半导体的性能
C.锗化氢(GeH4)稳定性很强 D.锗酸(H4GeO4)是难溶于水的强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成+2价?写出有关反应的化学方程式或离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·L-1的硫酸溶液50 mL,恰好完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6a g B.(a-1.6) g
C.(a-3.2) g D.1.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
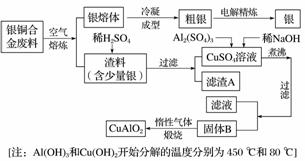
(1)电解精炼银时,阴极反应式为_______________________________;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为____________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3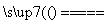 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要 1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com