
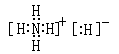
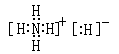


科目:高中化学 来源:不详 题型:单选题

| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R>W |
| C.WX3和水反应形成离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物不能相互反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 族 族周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
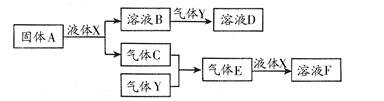
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第三周期金属元素的氧化物都属于碱性氧化物 |
| B.电子层结构相同的不同离子,其半径随核电荷数增大而减小 |
| C.IA族元素的金属性一定比IIA族元素的金属性强 |
| D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com