
| A. | 加热前消耗的多 | |
| B. | 加热后消耗的多 | |
| C. | 加热前后均消耗0.02amolHCl | |
| D. | 当n(NaOH)>n(NaHCO3)时消耗的才会一样多 |
分析 无论是否加热,agNaHCO3和NaOH与盐酸反应都生成NaCl,由Na原子守恒可知,消耗的盐酸的物质的量相同,结合混合物中含有钠的质量分数进行计算.
解答 解:加热前:NaHCO3~NaCl,NaOH~NaCl,加热后可存在Na2CO3~2NaCl,由转化关系可知:无论是否加热,与盐酸反应都生成NaCl,由Na原子守恒可知,消耗的盐酸的物质的量相同,
混合物中含钠的质量分数为46%,则混合物中含有钠的物质的量为:$\frac{ag×46%}{23g/mol}$=0.02amol,所以加热前后消耗HCl的物质的量都是:n(HCl)=n(NaCl)=0.02amol,
故选C.
点评 本题考查钠的化合物的性质、化学方程式计算,题目难度不大,注意根据关系式从质量守恒的角度解答,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测试 | B. | 用闻气味和pH试纸测试 | ||
| C. | 用Ba(OH)2溶液和酚酞试液 | D. | 用NaOH和BaCl2溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验结论 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

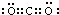 、
、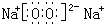 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com