
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

下列叙述正确的是
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液酸性减弱
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-=O2↑+4H+,负极区溶液pH降低
D.当电路中通过1 mol电子的电量时,会有16 g O2生成
【答案】B
【解析】
在直流电场下,该装置是电解装置,正极其实是电解装置的阳极、正极区其实是电解装置的阳极区,负极其实是电解装置的阴极、负极区其实是电解装置的阴极区,因为是惰性电极,因此溶液中的离子在电极上发生反应,据此回答;
A. 通电后中间隔室的SO42-离子向正极迁移,正极上发生氧化反应,电极反应为2H2O-4e-=O2↑+4H+,正极区溶液酸性增强,A错误;
B. 该法在处理含Na2SO4废水时,通电后两端隔室中离子被阻挡不能进入中间隔室,中间隔室的SO42-离子向正极迁移,正极上发生氧化反应,电极反应为2H2O-4e-=O2↑+4H+,中间隔室的钠离子向负极迁移,负极上发生还原反应,电极反应为4H2O+4e-=2H2↑+4OH-,负极区得到NaOH产品,B正确;
C. 正极反应为2H2O-4e-=O2↑+4H+,正极区溶液pH降低,负极上发生反应为4H2O+4e-=2H2↑+4OH-,负极区得到NaOH,溶液pH增大,C错误;
D. 按反应2H2O-4e-=O2↑+4H+,当电路中通过1 mol电子的电量时,会有8 g O2生成,D错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷。三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
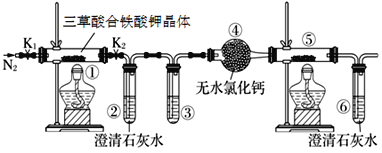
(1)分解得到的气体产物用如下装置进行实验:检查装置气密性后先通一段时间的N2,其目的是_____________;为了实验安全,应先点燃___________________(①或⑤)处的酒精灯;
(2)若③和⑤中分别盛放_____________ 、_______________就可检验生成的CO;
(3)分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)a g样品![]() 溶液
溶液![]()
![]() 得固体b g
得固体b g
(乙)a g样品![]() 配制250 mL溶液
配制250 mL溶液![]() ,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是__________,不可确定样品组成的方案的理由是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是
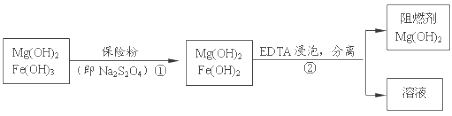
A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,两电极上发生的电极反应为a极:Cu2++2e-=Cu;b极:Fe-2e-=Fe2+。下列说法不正确的是
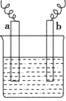
A.电解质溶液含有Cu2+
B.该装置是化学能转化为电能
C.a、b可能是同种电极材料
D.a极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何综合利用有毒的NO2气体一直是科研的热门话题,根据反应4NO2+O2=2N2O5,有些科学家设计了如图所示的燃料电池,下列相关说法正确的是

A.图示中Y为NO,可以循环利用
B.电池工作过程中,NO3-向石墨Ⅰ电极迁移
C.正极发生的反应为NO+O2+e- =NO3-
D.转移1 mol电子时,负极产物为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物的有效成分(R)的结构简式如下。下列说法不正确的是
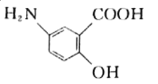
A. R能发生加成、取代反应
B. R分子中所有C和N原子一定共平面
C. R的苯环上官能团位置异构体有10种
D. R的分子式为C7H7O3N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行下图所示实验:
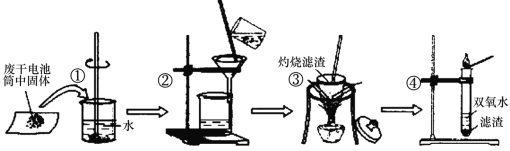
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)锌锰电池的负极材料是________。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有___________。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_________, 操作④相关的化学方程式为_______________。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中__________________(填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器请画出实验装置图,标出电极材料、电解质溶液_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是(已知质子交换膜的作用是只允许H+通过)( )

A.该电池在高温下工作的速度更快
B.HS-在硫氧化菌作用下转化为SO42-的电极反应式为HS-+4H2O-8e-=SO42-+9H+
C.b电极是电池的负极
D.该电池工作时,H+向左通过质子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com