
| A. | A和B可能是同分异构体 | |
| B. | A和B不一定是同系物 | |
| C. | A和B完全燃烧后生成的水的质量相等 | |
| D. | A和B含碳的质量分数相同 |
分析 烃中只有碳氢两种元素,A、B两种烃,含氢的质量分数相同,则含碳的质量分数相同,所以A、B两种烃最简式相同,可能是同分异构体,也可能是同系物,据此回答问题.
解答 解:因烃中只有碳氢两种元素,含氢的质量分数相同,则含碳的质量分数相同,则最简式相同.
A、最简式相同,可能是同分异构体,如丙烯与环丙烷,可能是同系物,如乙烯与丙烯,故A正确;
B、最简式相同,可能是同分异构体,如丙烯与环丙烷,不一定是同系物,故B正确;
C、由于烃的质量未知,尽管氢的质量分数相同,但A和B完全燃烧后生成的水的质量不一定相等,故C错误;
D、烃中只有碳氢两种元素,含氢的质量分数相同,则含碳的质量分数相同,故D正确;
故选C.
点评 本题考查同分异构体与同系物概念、有机物结构判断等,注意同分异构体、同系物等概念的内涵与外延.


科目:高中化学 来源: 题型:选择题
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | W元素的晶体单质是一种良好的半导体材料 | |
| C. | X分别与Y,Z,M,W形成的常见化合物中,稳定性最好的是XM | |
| D. | 化合物乙中一定只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 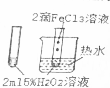 验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 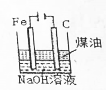 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  验证盐酸、碳酸、苯酚酸性的强弱 | |
| D. |  制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定化学式→确定最简式→确定结构式 | |
| B. | 分离、提纯→确定最简式→确定化学式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定最简式→确定化学式 | |
| D. | 确定化学式→确定最简式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
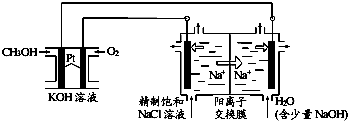
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
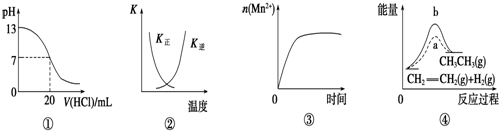
| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的总能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 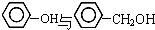 相差一个CH2,互为同系物 相差一个CH2,互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的乙炔、苯、苯乙烯(C8H8)分别完全燃烧,耗氧量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有七行,七个周期,有18列,18个族 | |
| B. | 目前使用的元素周期表中,同一主族的元素最外层电子数相同 | |
| C. | 短周期元素是指1~20号元素,其中大多数为非金属 | |
| D. | 元素周期表中,元素的种数与对应的原子种数一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com