
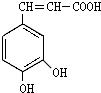
 咖啡酸(结构如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(结构如图)存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
. .
. 分析 (1)含氧官能团为-COOH、-OH;
(2)含酚-OH、C=C、-COOH,结合酚、烯烃、羧酸的性质来解答;
(3)碳碳双键可发生加成反应,酚羟基邻位、对位氢原子可被溴取代;
(4)只有羧基与NaHCO3溶液反应;
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为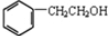 .
.
解答 解:(1)由 可知,含氧官能团为羧基、羟基(酚羟基),故答案为:羧基、羟基(酚羟基);
可知,含氧官能团为羧基、羟基(酚羟基),故答案为:羧基、羟基(酚羟基);
(2)含有碳碳双键,可发生加成反应,含有羧基,可发生酯化反应,不能发生水解、消去反应,故答案为:②③;
(3)碳碳双键可发生加成反应,酚羟基邻位、对位氢原子可被溴取代,则1mol咖啡酸与浓溴水反应时最多消耗 4mol Br2,故答案为:4;
(4)只有羧基与NaHCO3溶液反应,反应的方程式为 ,
,
故答案为: ;
;
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为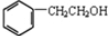 ,可与
,可与 发生酯化反应,
发生酯化反应,
故答案为: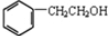 .
.
点评 本题考查有机物的结构和性质,注意有机物的含有的官能团的性质,熟悉苯酚、烯烃、羧酸的性质即可解答,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 石油的分馏、煤的干馏均是物理变化 | |
| B. | 应当大力实施矿物燃料“脱硫“、脱硝技术”,减少硫的氧化物和氮氧化物的污染 | |
| C. | 近期我国华北地区出现雾霸天气,PM2.5超标.PM2.5仅来自煤的燃烧 | |
| D. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
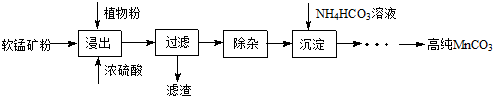
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
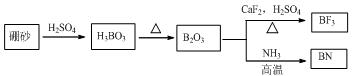
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋和料酒的主要成分都是有机酸 | |
| B. | 食盐和味精的成分中都含有钠离子 | |
| C. | 食用油和人造奶油都是油酸甘油酯 | |
| D. | 蔗糖和小苏打都是可溶于水的电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用水润湿的 pH 试纸测量某溶液的 pH | |
| B. | 用量筒量取 20 mL 0.5000 mol/LH2SO4溶液于烧杯中,加水 80 mL,配制成 0.1000 mol/LH2SO4溶液 | |
| C. | 实验室用图Ⅰ所示装置制取并收集少量氨气 | |
| D. | 实验室用图Ⅱ所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com